アルケンやアルキンのヒドロヨウ素化、活性芳香族化合物のヨウ素化:ヨウ化アルカリを用いたヨウ素化反応①:臭素化・ヨウ素化反応解説シリーズ 24
マナックが得意とする、臭素化・ヨウ素化反応について解説する本シリーズ。
過去説明してきたN-ブロモ化合物などの臭素化剤によって生成される臭素化物は、医薬品や半導体など、さまざまな分野の中間体として活躍しています。そして、これらの産業において臭素化物と並んで重要なのが、ヨウ化物です。そこでヨウ化物をつくるための「ヨウ素化反応」に引き続き焦点を当てていきます。
今回は、ヨウ化ナトリウムやヨウ化カリウムに代表される「ヨウ化アルカリ」を用いたヨウ素化反応を特集します。ヨウ化アルカリは比較的安価に入手できて扱いやすいため、ヨウ化物の合成試薬として多くの場面で活躍しています。ヨウ素化反応を扱う上で、ヨウ化アルカリに関する知識は避けて通れないと言えるでしょう。
今回の記事では、代表的なヨウ化アルカリであるヨウ化ナトリウム、ヨウ化カリウム、ヨウ化リチウムの特徴を解説した後で、ヨウ化アルカリを用いたヨウ素化反応をくわしく解説します。本記事の内容を参考に、ヨウ化アルカリへの理解を深めてください。
contents
代表的なヨウ化アルカリの特徴
実験室で一般合成に使用されるのは主にヨウ化ナトリウムとヨウ化カリウムですが、金属イオンの配位効果を期待する場合はヨウ化リチウムも利用されます。
主なヨウ化アルカリの特徴は以下の通りです。
ヨウ化ナトリウム(NaI)
物性や用途など
ヨウ化ナトリウム(NaI)は、分子量149.894(I:84.66%)の、潮解性を示す白色結晶です。融点は661~662℃、沸点は1304℃、密度は3.667。なめるとやや苦味がかった塩味がします。
水にきわめてよく溶け、アルコールやグリセリン、アセトン、液体アンモニアにもかなり溶ける点が特徴です。65℃超の水溶液から析出させると無水塩となりますが、室温で結晶化させると2水塩(密度:2.448)となります。
ヨウ化ナトリウムはヨウ素化剤として使用されるほか、ヨウ素欠乏症 やバセドウ病 の治療などにも活用されます。最近ではヨウ化銀に代わり、降雨目的の空中散布にも利用され始めています。
工業用の薬品は、マナックがヨウ素分野で提携している株式会社合同資源などから購入できます。
注意点
ヨウ化ナトリウムを空気中に放置すると、酸化されて次第に黄色を帯びてきます。変色を避けるには、~1%の次亜リン酸アンモニウムを添加しましょう。
ヨウ化ナトリウムが強酸と反応すると、劇物であるヨウ化水素が発生します。また、酸化剤と反応すると、腐食性が強いヨウ素が遊離します。そのため、ヨウ化ナトリウムを強酸や酸化剤と接触させないよう注意が必要です。
ヨウ化ナトリウムの急性毒性は、LDLo 4340mg/kg(ラット/経口)、1060mg/kg(ラット/静注)です。ヨウ化ナトリウムは眼、粘膜、皮膚を刺激しますが、体内に入ると大部分は腎臓からすみやかに排出されます。
ヨウ化カリウム(KI)
物性や用途など
ヨウ化カリウム(KI)は、分子量166.02(I:76.45%)の、吸湿性を示す白色結晶です。融点は681~682℃、沸点は1330℃、密度は3.130。ヨードカリ、ヨウポツとも呼ばれます。なめるとやや苦味がかった塩味がします。
水によく溶け、アルコールやアセトン、液体アンモニアにもかなり溶けますが、エーテルには難溶です。また、水溶液はヨウ素をよく溶かし、三ヨウ化カリウム(KI3)を生成します。
ヨウ化カリウムは局方薬として、去たん、利尿、甲状腺の機能亢進などの目的で内服されます。また、ヨウ化カリウムと可溶化デンプンを3:5の重量比で水に溶かし、濾紙を浸漬したのち乾燥させたものは「ヨウ化カリウム-デンプン紙」と呼ばれ、微量酸化剤の検出に活用されます(ただし、強い酸化剤の場合はうまく検出できないケースもあります)。
工業用のヨウ化カリウムは、株式会社合同資源などから購入可能です。
注意点
ヨウ化カリウムはヨウ化ナトリウムと同様、強酸の作用でヨウ化水素を発生し、酸化剤により腐食性が強いヨウ素を遊離するため、これらと触れないよう注意が必要です。
急性毒性はLDLo 910/1860mg/kg(マウス/ウサギ、経口)、1120mg/kg(マウス/腹腔)、120mg/kg(ラット/静注)で、魚毒性はLD50 3200mg/L(ニジマス/5日)です。微粉末は眼や粘膜、皮膚を刺激するため、吸入や接触はできるだけ避けましょう。
ヨウ化リチウム
物性や用途など
ヨウ化リチウム(LiI)は、分子量133.84の白色結晶です。融点は446℃、密度は3.890。アルコールやエーテル系触媒には、低温でもよく溶けます。
ヨウ化リチウムは、リチウムイオンの配位による立体制御を期待してヨウ素化試薬として利用されることもあります。例えばMaらは、プロピオル酸アリル(allyl propiolate)またはプロピオル酸プロパルギル(propargyl propiolate)を酢酸中でヨウ化リチウムと反応させた場合、反応中にLi+イオンがカルボニル酸素に配位するため、プロピオル酸部分の三重結合が位置および立体選択的にヒドロヨウ素化された生成物が得られると報告しています2)。 しかし、ヨウ化リチウムはヨウ素源としてはかなり高価なため、ヨウ化反応にはヨウ化ナトリウムやヨウ化カリウムを使用する方が一般的です。
ヨウ化アルカリを使用したヨウ化反応:アルケンやアルキンのヒドロヨウ素化
反応の詳細
ヨウ化アルカリは、酢酸やリン酸などのプロトン酸と組み合わせて、アルケンやアルキンのヒドロヨウ素化に利用されます。反応の詳細は以下の通りです。
① アルケンのヒドロヨウ素化
ヨウ化アルカリをプロトン酸と反応させると、in situでHIが発生します。このHIがMarkovnikov則にしたがってアルケンの二重結合に付加し(求電子付加反応)、生成物として第二級または第三級ヨードアルカンが得られます。
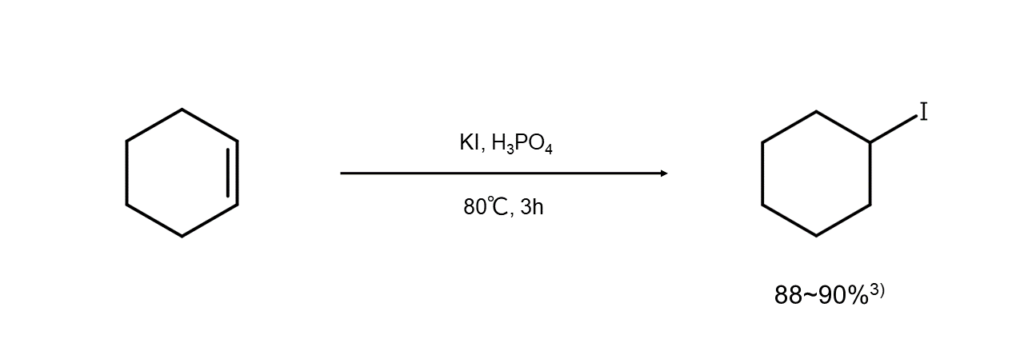
注目すべきことに、今回のようにヨウ化アルカリを使用する方が、HIを直接作用させるよりも収率が良くなる傾向があります。例えばStoneらは、シクロヘキセンにKIとH3PO4を作用させて、88~90%の高収率でヨードシクロヘキサンを合成することに成功しています3) 。
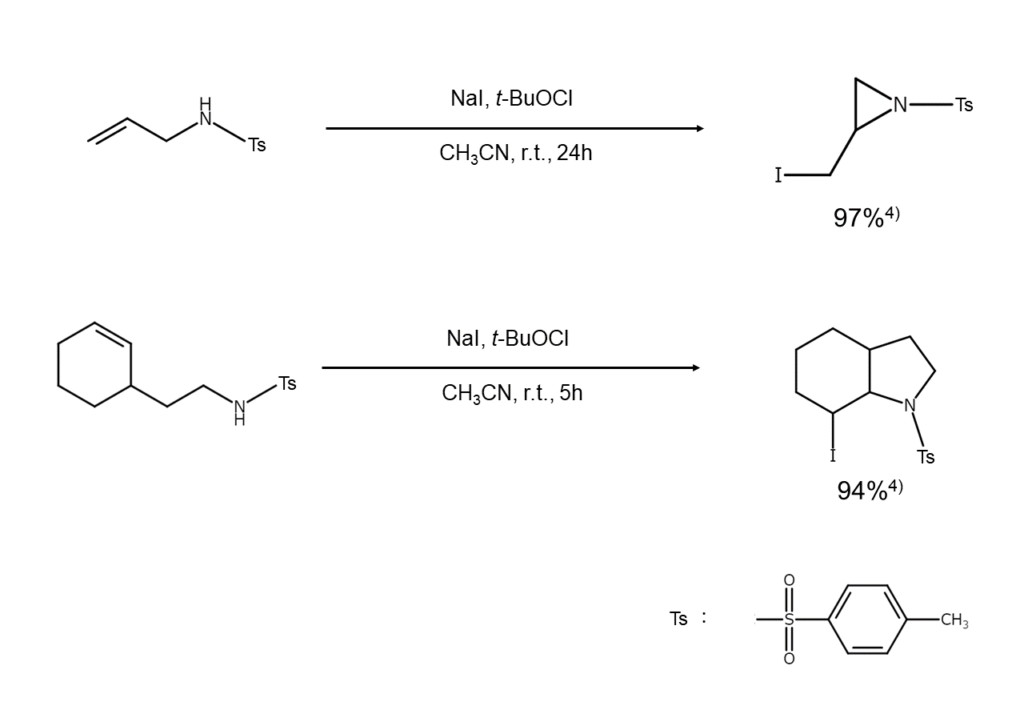
ヨウ化アルカリを用いれば、ヨウ素化とともに分子内環化を起こすことも可能です。β~ε位に二重結合をもつアルケニルアミンをトシルアミドに変えてNaI-次亜塩素酸t-ブチル(CH3)3COClで処理すると、ヨウ素化をともなった分子内環化が起こり、ヨウ素官能基をもつ窒素環化合物が得られます。
上記の反応機構は以下のように説明されています。最初にハロゲン交換により次亜ヨウ素酸t-ブチル(CH3)3COIが発生し、これによるN-ヨウ素化で生じたN-ヨードスルホンアミドが、分子内でオレフィン結合を攻撃してヨードニウムイオン中間体に変わったのち、窒素原子に補足されてヘテロ環が形成されます。Minakataらは本反応で、3員から6員の飽和N-ヘテロ環を、高収率かつ完全な立体選択性で生成できたと報告しています4) 。
分子内環化をともなうアルケンのヨウ素化反応例を、以下に示します。
② アルキンのヒドロヨウ素化
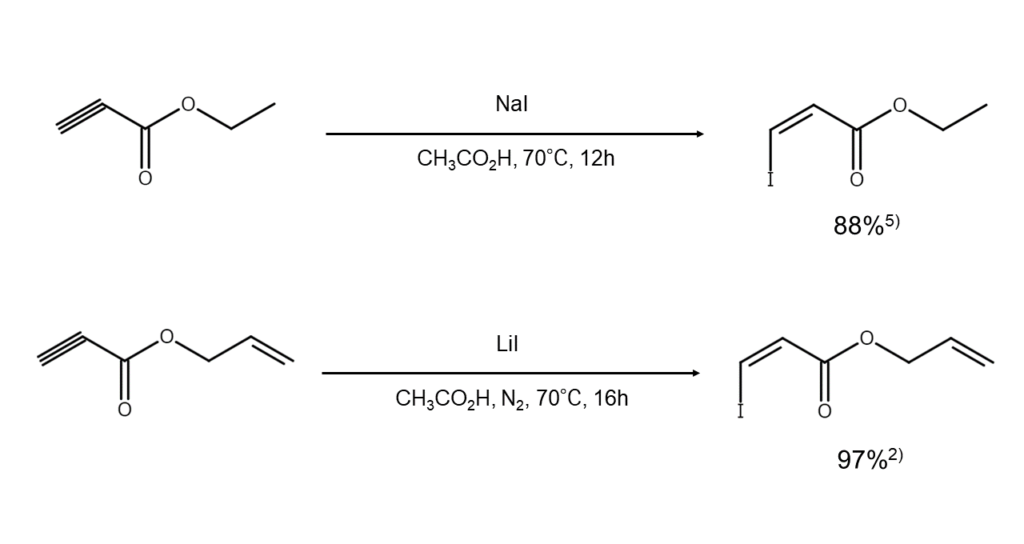
アルキンのヒドロヨウ素化は、アルケンに比べて起こりにくい点が特徴です。しかし、エチニルケトンのような電子不足の共役ケトンに対してはMiIchaelタイプの付加が容易に起こり、β-ヨードビニルケトンが高収率で得られます5) 。
また、上記反応生成物の立体化学は酸の強度に支配されます。Taniguchiらは、末端アセチレン基を有するケトンをヨウ化ナトリウムと反応させた場合、トリフルオロ酢酸(TFA)中では主にE体が、酢酸中では主にZ体が得られたと報告しています。さらに、反応混合物を長時間放置すると、徐々にZ体からE体への異性化が起こることも報告しています6) 。
ヨウ化アルカリを用いたアルキンのヒドロヨウ素化反応例を、以下に示します。
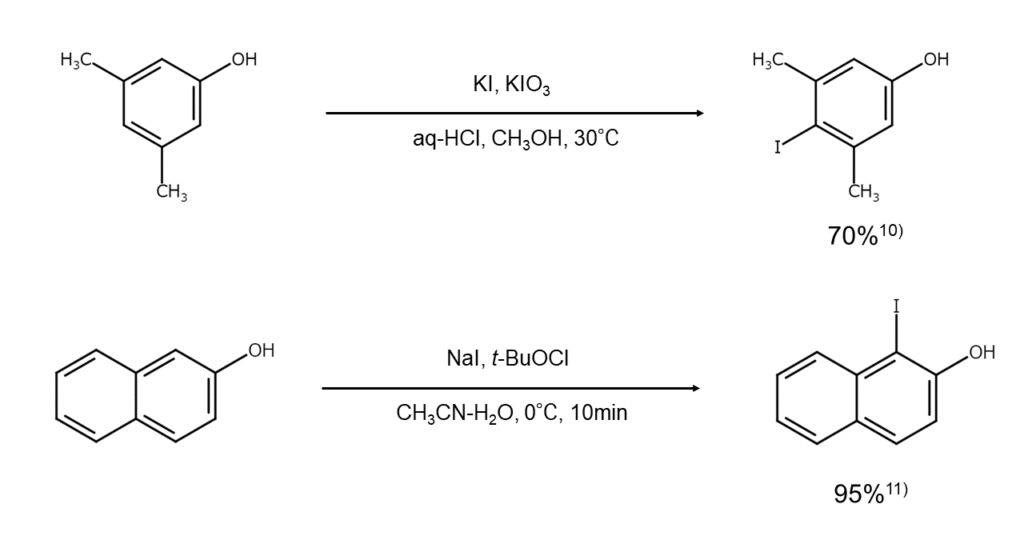
ヨウ化アルカリを使用したヨウ素化反応:活性芳香族化合物のヨウ素化
反応の詳細
ヨウ化アルカリを穏やかな酸化剤と組み合わせれば、アルキルベンゼンやフェノール、フェノールエーテルなどの活性な芳香族化合物をヨウ素化できます。
Iin situに発生した次亜ヨウ素酸によるヨウ素化や、電子移動によるカチオンラジカルの発生を経由するヨウ素化など、その反応機構はさまざまです。反応条件や収率の面で優れた反応が多いため、有用なヨウ素化法として古くからよく用いられています。
例えば、酸化剤として酸素と触媒量のニトロソニウム塩NO+BF4-を使用すると、ヨウ化アルカリおよびTFAの存在下で活性な芳香族化合物をヨウ素化できます。ただし、この反応はニトロソニウムイオンNO+による基質の一電子酸化を経て進行するため、ヨウ素化は酸化還元電位の低いアレーンに限られます7) 。このほか、希土類金属試薬である硝酸セリウム(IV)アンモニウムを用いた酸化反応8) や、ヨウ化カリウムと過酸化水素を用いたヨウ素化反応9) なども知られています。
ヨウ化アルカリと酸化剤を用いたヨードアレーンの合成例を、以下に示します。
参考文献
1) 鈴木仁美 監修、マナック(株)研究所 著、「臭素およびヨウ素化合物の有機合成 試薬と合成法」、丸善出版
2) Ma, S., Lu, X. Tetrahedron Lett., 1990, 31, 7653.
3) Stone, H., Shechter, H. Org. Synth. Coll. Vol. IV, 543(1963).
4) Minakata, S. Morino, Y. et al. Org. Lett., 2006, 8, 3335.
5) Marek, I., Meyer, C. et al. Org. Synth., 1997, 74, 194. ; Coll. Vol. IX, 510 (1998).
6) Taniguchi, M., Kobayashi, S. et al. Tetrahedron Lett., 1986, 27, 4763.
7) Rander, F. J. Org. Chem., 1988, 53, 3548.
8) Sugiyama, T. Bull. Soc. Chem. Jpn, 1981, 54, 2847.
9) Iskra, J., Stavber, S et al. Synthesis, 2004, 1869.
10)Hünig, S., Schwarz, H. Liebigs Ann. Chem., 1956, 599, 131.
11)Kometani, T., Watt, D. S. et al. Tetrahedron Lett. 1985, 26, 2043