臭化リンを用いた臭素化反応(ブロモホスホラン):臭化リン④:臭素化・ヨウ素化反応解説シリーズ42
マナックが得意とする臭素化・ヨウ素化反応について解説する本シリーズは、「臭化リンを用いた臭素化反応」に入っています。
今回取り上げるのは、「ブロモホスホランを試薬とする反応」です。2つのブロモホスホラン試薬「ジブロモトリフェニルホスホラン」と「1,2-ビス(ジブロモジフェニルホスホラニル)エタン」に着目し、これらによる代表的なブロモ化反応を解説します。
特にアルコールからブロモアルカンを合成する反応においては、「副生成物が少ない」「OH基を保護したままブロモアルカンに変換できる」など、多くのメリットがあるので必見ですよ。ぜひ、最後までご覧ください。
contents
臭化リンを用いた臭素化反応:ブロモホスホランを試薬とする反応
ジブロモトリフェニルホスホラン(臭素-トリフェニルホスフィン)
ジブロモトリフェニルホスホラン(C6H5)3PBr2は、トリフェニルホスフィンに等モルの臭素を作用させると生じる5価のリン化合物です。吸湿性を示す無色の結晶で、湿った空気と接触するとHBrを発生して分解します。また、酸化剤や塩基と接触しても容易に分解します。ジクロロメタンやアセトニトリル、ベンゾニトリル、DMFにはよく溶けますが、ベンゼンやクロロベンゼンには微溶です。
腐食性があり、皮膚や粘膜を刺激するため、ドラフト内で扱うのが望ましいとされています。また、保存したい場合は密栓した状態で乾いた冷暗所に保管します2)。
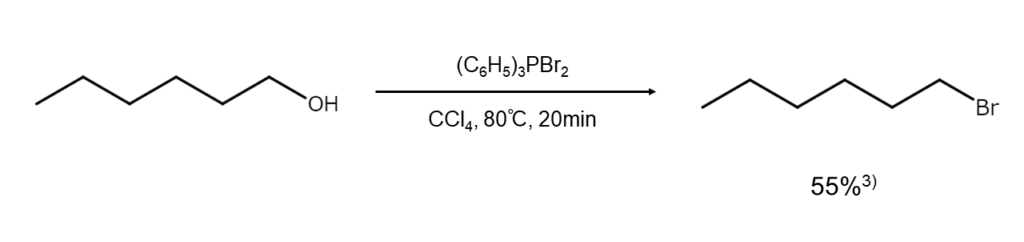
臭素化反応(i) アルコールからブロモアルカンの合成
反応機構
ジブロモトリフェニルホスホランは、極性溶媒中でブロモホスホニウム塩[(C6H5)3P+Br]Br–としての挙動を示します。このブロモホスホニウム塩にアルコールを作用させると、すみやかに配位子交換を行ってアルコキシホスホニウム塩に変わったのち(以下の式(1))、臭素イオンの求核攻撃を受けて徐々にブロモアルカンとホスフィンオキシドへ分解します(以下の式(2))。SN2反応のため、光学活性なアルコールからは立体配置が反転したブロモアルカンが得られます2)。
[(C6H5)3P+Br]Br– + ROH → [(C6H5)3P+OR]Br– + HBr 式(1)
[(C6H5)3P+OR]Br– → RBr + (C6H5)3P=O 式(2)
この反応は、主に第一級および第二級アルコールからブロモアルカンを合成する際に使用されます。有機溶媒(主にアセトニトリルやDMF)を用いて中性条件下で反応を行えるため、酸や塩基に対して敏感な糖やヌクレオシドのヒドロキシ基を臭素原子で置換するのに便利です。
ジブロモトリフェニルホスホランを用いたアルコールからブロモアルカンの合成例を、以下に示します。
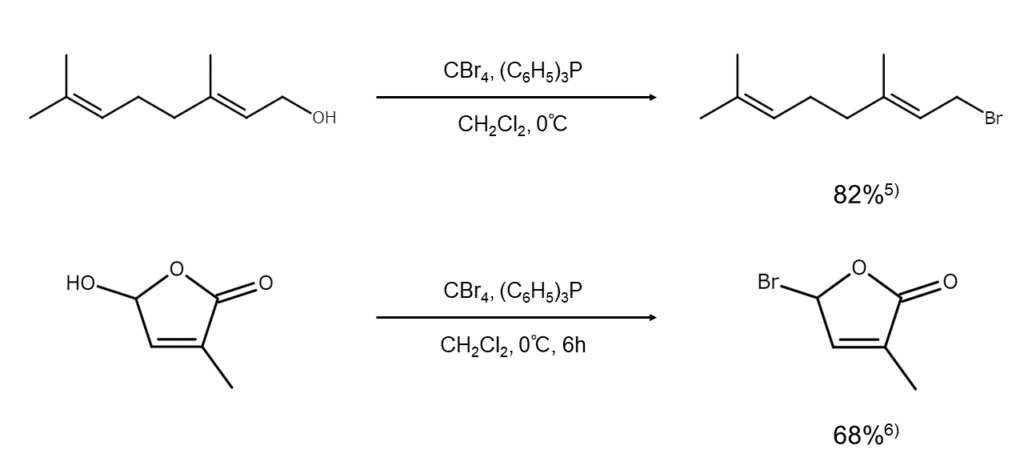
骨格転移が起こりにくいなど、多くのメリットあり
この反応は、シクロプロピル基やオレフィン結合のように反応性に富む官能基をもつ化合物にもうまく適用できます。また、反応過程でカルボカチオンが発生しないため骨格転移が起こりにくく、副生成物が少ない点もメリットです。
例えば、臭化水素や臭化リン(III)を用いると容易に異性化が起こるネオペンチルアルコールも、ジブロモトリフェニルホスホランを用いれば異性化をともなわずに臭化物へと変わります4)。
別の臭素源を使用する方法もある
ジブロモトリフェニルホスホラン(単体臭素とトリフェニルホスフィンの組み合わせ)では満足な結果が得られない場合、臭素源として、単体臭素の代わりにN-ブロモスクシンイミド(NBS)や四塩化炭素を用いると好結果が得られるケースもあります。以下に反応例を示します。
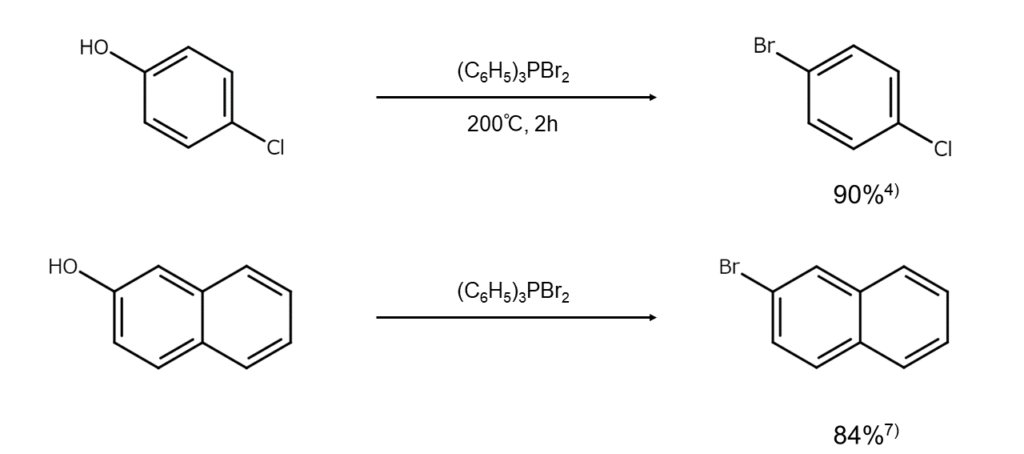
臭素化反応(ii) フェノールからブロモアレーンの合成
ジブロモトリフェニルホスホランを用いて、フェノールを臭化アリールへ変換する方法が報告されています。反応例は以下のとおりです。
臭素化反応(iii) エーテルからブロモアルカンの合成
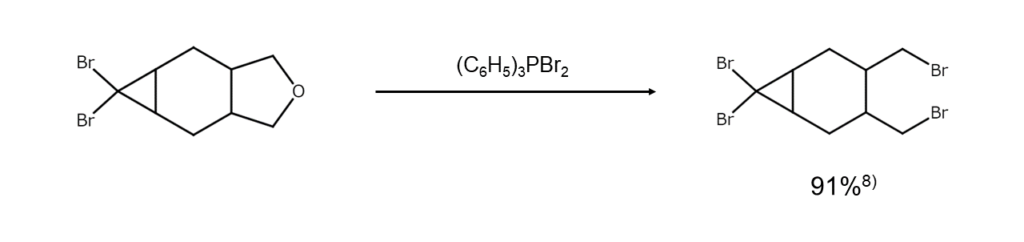
非対称ジアルキルエーテルをジブロモトリフェニルホスホランと加熱すると、円滑な臭素化開裂が起こり、2種のブロモアルカンの混合物が得られます。反応溶媒としては、クロロベンゼンやベンゾニトリル、DMF、NMPなど沸点の高いものが使用されます。第一級および第二級アルキル基をもつエーテルは比較的低温で反応が起こるため、溶媒による副反応を避けることができ、目的物が好収率で得られます。反応例は以下のとおりです。
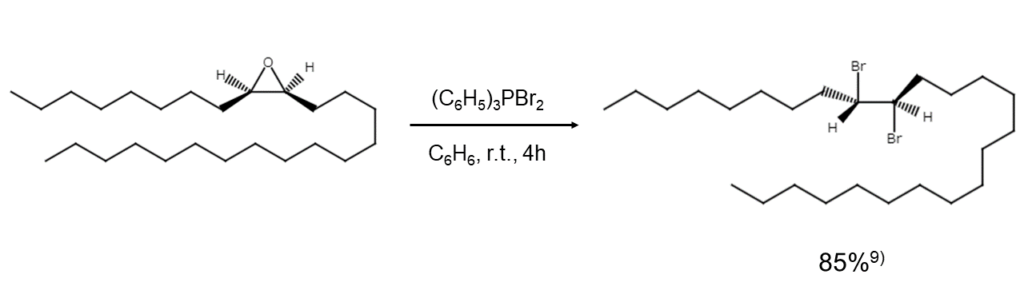
ジブロモトリフェニルホスホランでエポキシドを開環させると、vic-ジブロモアルカンが得られます。trans-エポキシドとの反応は立体選択性が乏しいため異性体の混合物が生じますが、cis-エポキシドからは以下のようにerythro-ジブロミドのみが生成します9)。
トリアルキルシリルエーテルを用いた場合は、温和な中性条件下でブロモアルカンを合成できます4)。
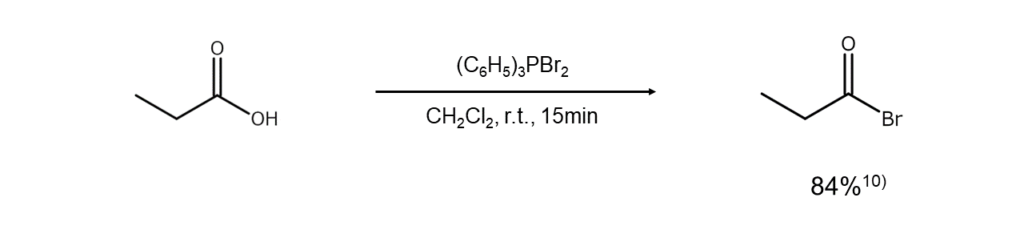
臭素化反応(iv) カルボン酸、酸無水物、エステルから酸臭化物の合成
カルボン酸や酸無水物にジブロモトリフェニルホスホランを作用させると、酸臭化物が容易に得られます。
1,2-ビス(ジブロモジフェニルホスホラニル)エタン
このビスホスホラン試薬[(C6H5)2Br2P]CH2CH2[PBr2(C6H5)2]は、特定の官能基を選択的に臭素化できる便利な化合物です。ジクロロメタンに代表される塩素系溶媒によく溶け、溶液は冷暗所で安定に保存できます。臭素と同じく皮膚や粘膜を侵すため、触れないように注意しましょう。
臭素化反応
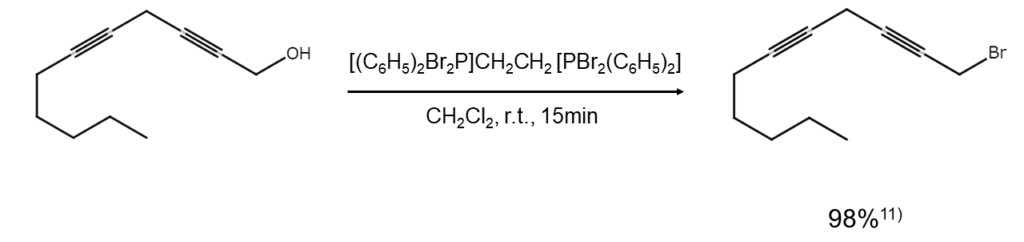
1,2-ビス(ジブロモジフェニルホスホラニル)エタンは、t-ブチルジメチルシリル(TBDMS)基やエステル基に影響を与えず、アルケンやアルキンの不飽和結合とも反応しません。このように官能基選択性が優れているため、多官能性の化合物の部分構造を選択的に臭素化したい場合に便利です11)〜13)。例えば、以下のように多官能性のアルコールを穏やかな条件下でブロモアルカンへ変換する際に利用されます。
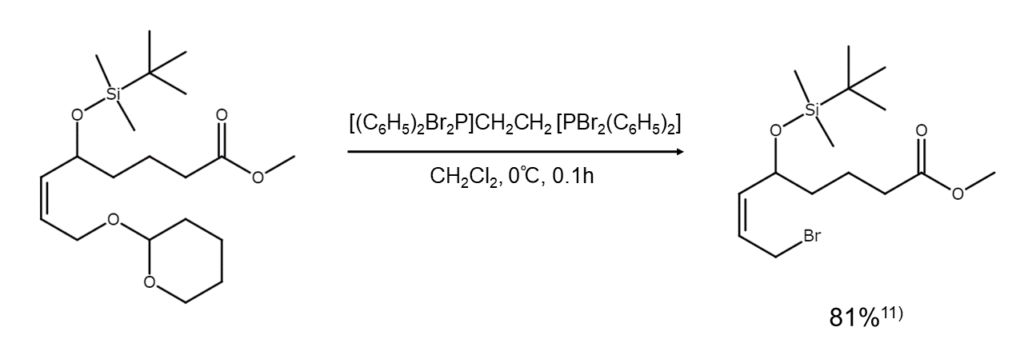
また、1,2-ビス(ジブロモジフェニルホスホラニル)エタンを使えば、テトラヒドロピラニル(THP)基で保護したアルコールを直接ブロモアルカンに変換することも可能です。
【コラム】DMFを使うと反応機構が変化する!? 溶媒が反応機構に与える影響とは
今回の記事では、「ジブロモトリフェニルホスホラン(C6H5)3PBr2は極性溶媒中でブロモホスホニウム塩[(C6H5)3P+Br]Br–としての挙動を示す」こと、「ジブロモトリフェニルホスホランを用いてアルコールからブロモアルカンを合成する反応では、このブロモホスホニウム塩[(C6H5)3P+Br]Br–が実質的な出発物質である」ことを解説しました。以下に反応機構を再度示します。
[(C6H5)3P+Br]Br– + ROH → [(C6H5)3P+OR]Br– + HBr
[(C6H5)3P+OR]Br– → RBr + (C6H5)3P=O
しかし、実はこの反応、溶媒としてDMF((CH3)2NCHO)を使用すると少し事情が変わります。以下のように、DMFとジブロモホスホランの反応で発生したブロモイミニウム塩[BrCH=N+(CH3)2]Br–が実際の反応種として働くと考えられるのです。
(CH3)2NCHO + (C6H5)3PBr2 → [BrCH=N+(CH3)2]Br– + (C6H5)3P=O
[BrCH=N+(CH3)2]Br– +ROH → [ROCH=N+(CH3)2]Br– + HBr
[ROCH=N+(CH3)2]Br– → RBr + (CH3)2NCH(=O)
溶媒が異なると、反応機構も変わることがある。ぜひ、心に留めておいてくださいね。
参考文献
1) 鈴木仁美 監修、マナック(株)研究所 著、「臭素およびヨウ素化合物の有機合成 試薬と合成法」、丸善出版
2) Schaefer, J. P., Weinberg, D. S. J. Org. Chem., 1965, 30, 2635.
3) Horner, L., Oediger, H. et al. Liebigs Ann. Chem., 1959, 626, 26.4) Wiley, G. A., Hershkowitz, R. L. et al. J. Am. Chem. Soc., 1964, 86, 964.
4) Kocienski, P. J., Cernigliaro, G. et al. J. Org. Chem., 1977, 42, 353.
5) Heather, J. B., Mittal, R. S. D. et al. J. Am. Chem. Soc., 1971, 98, 3661.
6) Schaefer, J. P., Higgins, J. J. Org. Chem., 1967, 32, 1607.
7) Kato, M., Nomura, S. et al. Chem. Lett., 1986, 281.
8) Sonnet, P. E., Oliver, J. E. J. Org. Chem., 1976, 41, 3279.
9) Alzpurua, J. M., Palomo, C. Synthesis, 1982, 684.
10) Schmidt, S. P., Brooks, D. W. Tetrahedron Lett., 1987, 28, 767.
11) Paquette, L. A., Rayner, C. M. et al. J. Am. Chem. Soc., 1990, 112, 4078.