最も強力な臭素化剤のひとつ、ジブロモイソシアヌル酸(DBI)の概要と反応機構:N-ブロモ化合物⑪:臭素化・ヨウ素化反応解説シリーズ 11
N-ブロモ化合物による臭素化反応を解説する本シリーズも、いよいよ最終回です。
本シリーズではこれまで、実験室での臭素化剤の第一選択であるN-ブロモスクシンイミド(NBS)、臭素化コストや副生物の量を少なくできる1,3-ジブロモ-5,5-ジメチルヒダントイン(DBDMH)、付加反応を優先的に起こせるN-ブロモアセトアミド(NBA)など、多くの臭素化剤を解説してきました。それぞれ、独自の特徴を持つ便利な臭素化剤です。
最終回となる本記事では、これらに負けず劣らず個性的な臭素化剤をご紹介します。N-ブロモ化合物の中でも最強クラスの臭素化能を持つ「ジブロモイソシアヌル酸(DBI)」です。DBIを使えば、ほかのN-ブロモ化合物では臭素化しにくい化合物も、比較的容易に臭素化できます。
今回は、DBIの特徴や取り扱い時の注意点、DBIを用いた臭素化反応などを解説します。また記事の末尾では、本シリーズでは取り上げなかったN-ブロモ化合物もいくつかご紹介します。
■ この記事でわかること ✔ DBIは温和かつ強力な臭素化剤で、NBSよりも強い臭素化能を示す ✔ DBIを使用すると、通常困難とされる不活性芳香環の臭素化を、穏やかな条件下で達成できる ✔ 世の中に存在するNBS、DBDMH、NBA、DBI以外のN-ブロモ化合物を紹介 ■ おすすめ記事 ・ アルケンへの付加反応を起こしやすい臭素化剤、N-ブロモアセトアミド(NBA)の概要と反応機構:N-ブロモ化合物⑩:臭素化・ヨウ素化反応解説シリーズ 10
contents
ジブロモイソシアヌル酸(DBI)とは
不活性芳香環を穏やかに臭素化できる、強力な臭素化剤
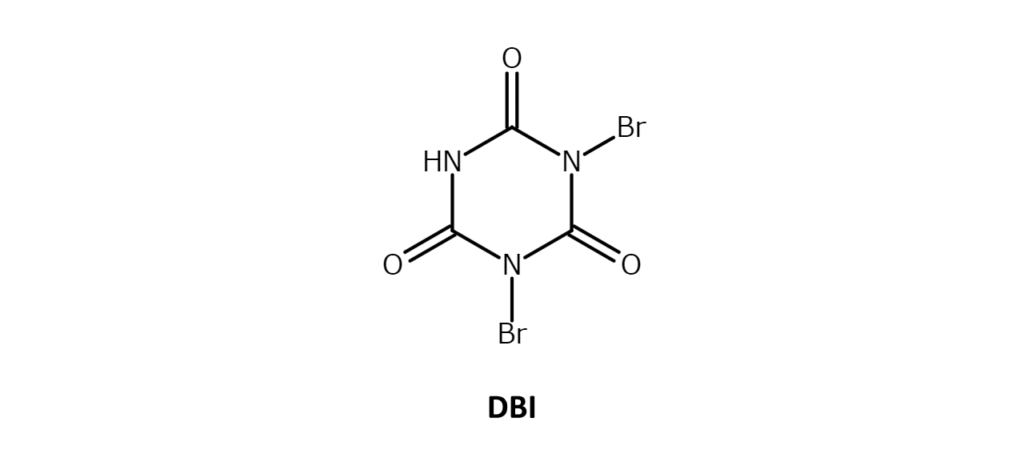
ジブロモイソシアヌル酸(DBI)は白~微黄色の結晶性粉末で、融点は309℃。ジクロロメタンと濃硫酸には溶解しますが、一般的な有機溶媒には難溶の化合物です。
DBIは温和かつ強力な臭素化剤で、不活性芳香環を穏やかな条件下で臭素化できます。反応の詳細は後述します。
DBIの調製方法と注意点
DBIは、水酸化アルカリ水溶液中でイソシアヌル酸に臭素を作用させる方法で、容易に調製できます2)。しかし、湿気や光で分解してしまうため、乾いた冷暗所で保存する必要があります。
DBIを扱う際の注意点
DBIを還元剤と接触させたり可燃物と混合したりすると、発火や爆発の危険があります。また、DBIは皮膚や粘膜を侵すため、体に触れないよう十分注意してください。
DBIを使用した臭素化反応:不活性芳香環の臭素化
反応の詳細
N-ブロモ化合物中の臭素原子は正に分極しており、電子が豊富な化合物に対して求電子的に作用します。そのため、電子供与基で活性化された芳香環をN-ブロモ化合物で臭素化するのは比較的容易です。反対に、電子求引基で不活性化された芳香環は臭素化が起こりにくくなります。
ここで登場するのがDBIです。DBIを使用すれば、通常困難とされる不活性芳香環の臭素化を、穏やかな条件下で達成できます。これは、強力な臭素化能を示すDBIだからこそできることです。
DBIを使用した臭素化反応例を以下に示します。
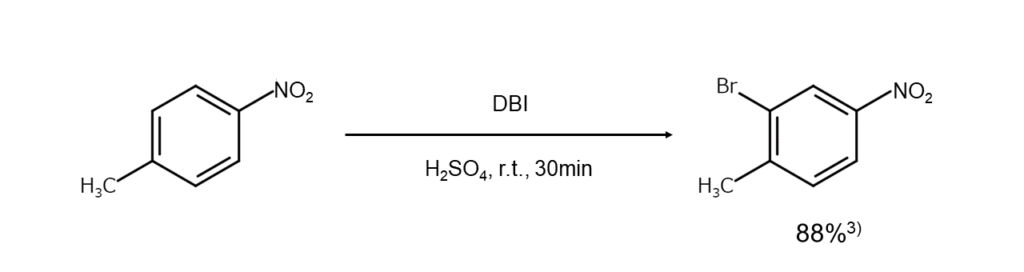
NBSとDBI、臭素化能はどちらが高い?
本記事で紹介したDBIと、代表的な臭素化剤であるNBS。一体どちらの臭素化能が高いのでしょうか。ニトロベンゼンの臭素化を例に、両者の臭素化能を比較してみましょう。
DBIを濃硫酸中で使用した場合、20℃・5分間という温和な反応条件でニトロベンゼンの臭素化は進行し、その収率は88%でした2)。一方、NBSを用いた場合でも92%という高い収率でニトロベンゼンの臭素化を行うことはできますが、三フッ化ホウ素一水和物の共存下、100℃・6時間といった厳しい反応条件が必要となります4)。
以上の結果から、一般にDBIはNBSよりも強い臭素化能を示すと考えられています。
【参考情報】その他のN-ブロモ化合物をご紹介
マナックの技術力の中核である、臭素化・ヨウ素化反応を解説する本シリーズ。これまでDBI以外にも、以下のN-ブロモ化合物を紹介してきました。
・N-ブロモスクシンイミド(NBS)
・1,3-ジブロモ-5,5-ジメチルヒダントイン(DBDMH)
・N-ブロモアセトアミド(NBA)
実は、世の中にはこれら以外にもさまざまなN-ブロモ化合物が存在します。その一部をご紹介しましょう。
N-ブロモフタルイミド
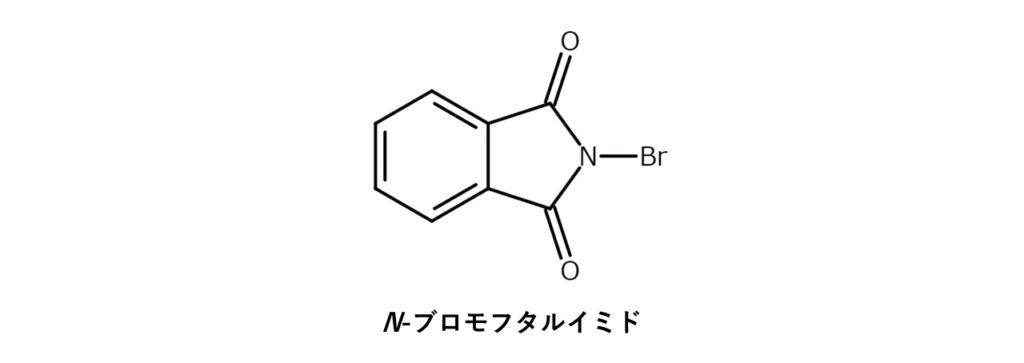
N-ブロモフタルイミドは、NBSと同じくアリル位の臭素化に使用できます。しかし、反応性が低い点やフタルイミド化を伴いやすい点がデメリットで、合成上の利点はあまりありません。
たとえば、N-ブロモフタルイミドをシクロヘキセンと反応させると、アリル位が臭素化された3-ブロモシクロヘキセンのほかに、副生物として2-ブロモ-1-フタルイミドシクロヘキサンが生成してしまいます5)。
N,N,N’,N’-テトラブロモベンゼン-1,3-ジスルホンアミド(TBBDA)
ポリ(N,N’-ジブロモ-N,N’-(エチレン)ベンゼン-1,3-ジスルホンアミド)(PBBS)
ポリ(N,N’-ジブロモ-N,N’-(1,3-フェニレン)ベンゼン-1,3-ジスルホンアミド)(PBPS)
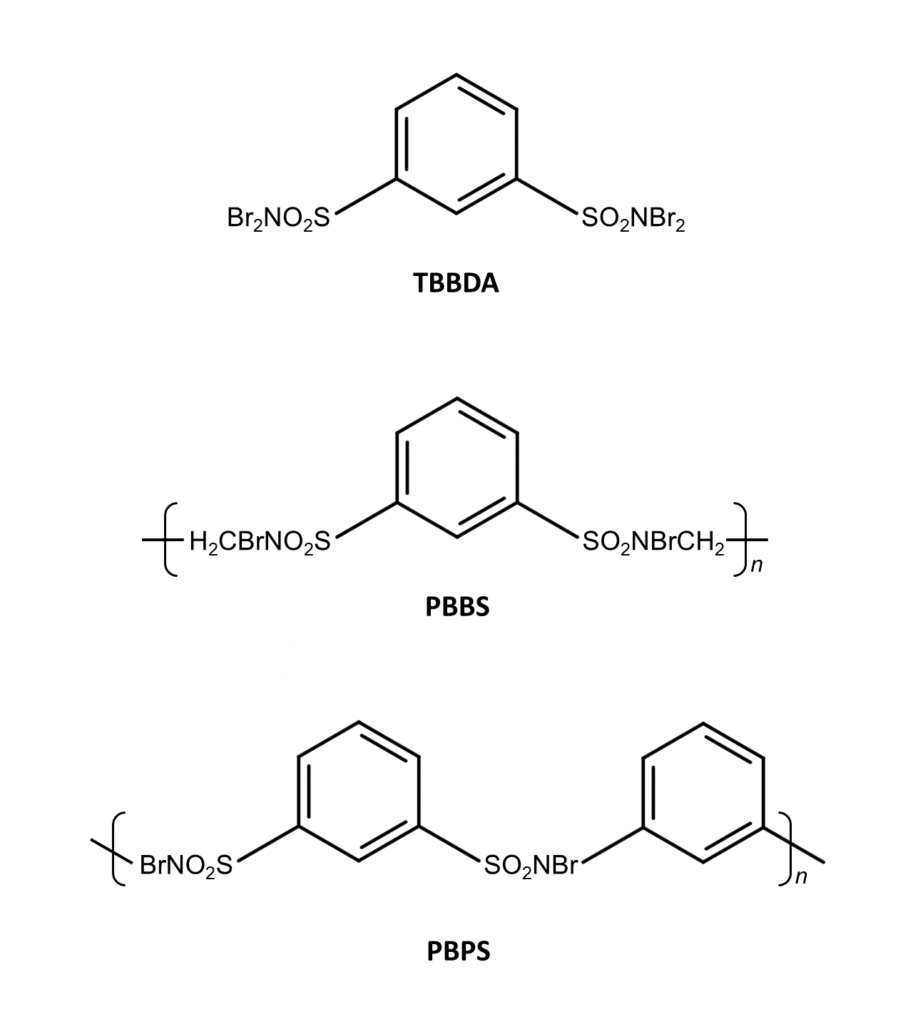
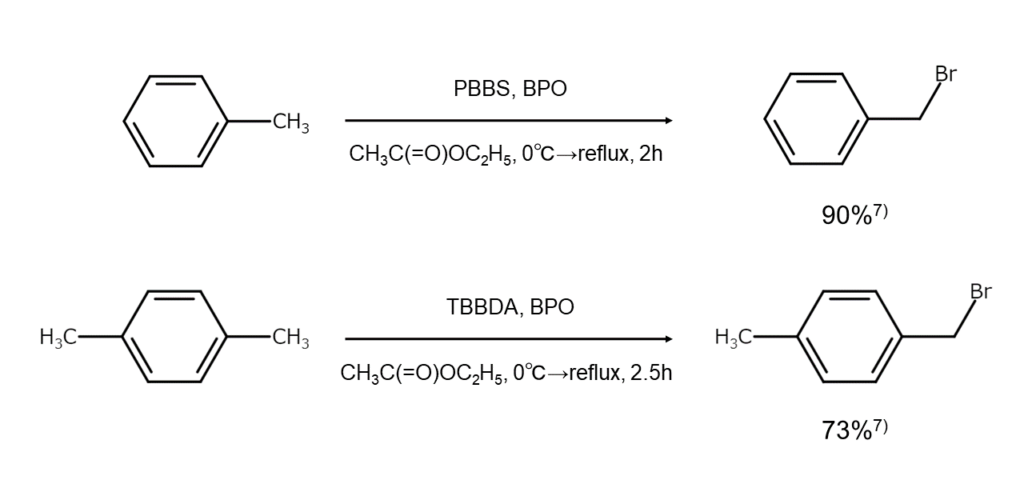
TBBDA、PBBS、PBPSは、NBSやDBDMHと同じくベンジル位の選択的な臭素化に使用できます。これらは容易に合成でき、通常の保存条件で2~3カ月は安定である点がメリットです6)。
以下に、PBBSとTBBDAを用いた臭素化反応例を示します。
マナックは、代表的なN-ブロモ化合物であるNBSおよびDBDMHを製造・販売しています。ぜひ、お気軽にお問い合わせください。
参考文献
1) 鈴木仁美 監修、マナック(株)研究所 著、「臭素およびヨウ素化合物の有機合成 試薬と合成法」、丸善出版
2) Gottardi, W. Monatsh., 1968, 99, 815; Chem. Abstr., 1968, 68, 114222h.
3) Gronowitz, S., Stenhammar, K. et al. Heterocycles, 1981, 15, 947.
4) Takemura, K., Suzuki, T. et al. Chem. Lett., 2003, 32, 932.
5) Ziegler, K., Späth, A. et al. Liebigs Ann. Chem., 1942, 551, 80.
6) Vaghei, R. G., Chegini, M. et al. Tetrahedron Lett., 2009, 50, 1861.
7) Ghorban-Vaghei, R., Chegini, M. et al. Tetrahedron Lett., 2009, 50, 1861.