アルケンの臭素付加やブロモヒドリン化、アルコールからブロモアルカンの合成:NBSを用いた臭素化反応③:N-ブロモ化合物⑤:臭素化・ヨウ素化反応解説シリーズ 5
マナックが得意とする、臭素化・ヨウ素化反応について解説する本シリーズ。NBSを使用したさまざまな臭素化反応を解説しています。
今回ご紹介するのは、「アルケンの臭素付加やブロモヒドリン化」「アルコールからブロモアルカンの合成」です。NBSを使用すれば、アルケンの二重結合に臭素を付加させたり、アリル位やベンジル位のアルコール基を臭素に変換したりできます。これらの反応機構や反応例を解説しますので、ぜひ研究や実験の参考にしてください。
■ この記事でわかること ✔ NBSは化合物中の水素原子などを臭素原子で置換するだけでなく、臭素原子を付加させることもできる ✔ アルケンの臭素付加反応にNBSを使用すれば、二重結合中の一方の炭素原子には臭素原子を、他方の炭素原子にはBr以外の置換基を付加させることができる ✔ 複雑な化合物を得たい場合は、NBSを使用した臭素化がおすすめ ■ おすすめ記事 ・ カルボニル基のα位の臭素化、カルボン酸と関連化合物の臭素化:NBSを用いた臭素化反応④:N-ブロモ化合物⑥:臭素化・ヨウ素化反応解説シリーズ 6 ・ 活性芳香環・不活性芳香環の臭素化:NBSを用いた臭素化反応②:N-ブロモ化合物④:臭素化・ヨウ素化反応解説シリーズ 4
contents
N-ブロモスクシンイミド(NBS)とは
取り扱いが容易で、非常によく使用される臭素化剤
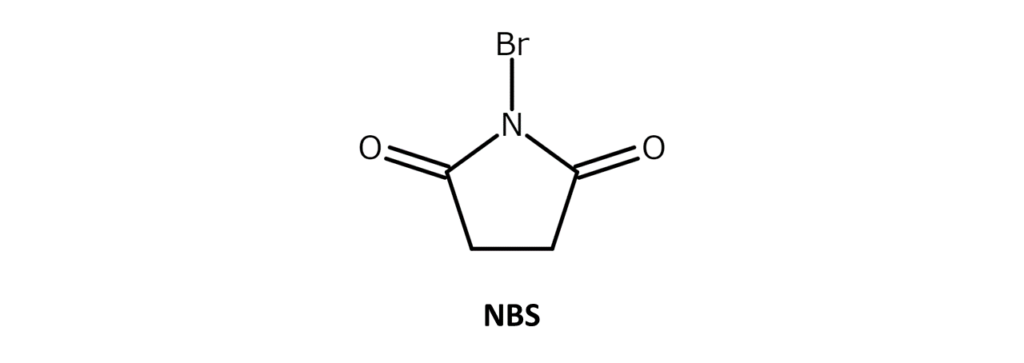
NBSは弱い臭素臭をもつ白~微黄色の結晶性粉末で、融点は173~176℃(分解)。アセトン、THF、DMF、アセトニトリル、DMSOなどに可溶で、水や酢酸には微溶、ヘキサンや四塩化炭素には難溶の化合物です。
粉末状で、臭素(液体)と比べて取り扱いが容易なため、有機合成では臭素化剤の第一選択としてよく使用されます。乾いた冷暗所で長期的に保存でき、値段も比較的安価です。
NBSの特徴や注意点、NBSを使用した臭素化反応の概要などに関しては、こちらの記事をご覧ください。
NBSを用いた臭素化反応:アルケンの臭素付加やブロモヒドリン化
反応の詳細
前回までに解説した「アリル位およびベンジル位の臭素化」「活性芳香環・不活性芳香環の臭素化」は、NBSを用いて化合物中の水素原子などを臭素原子で置換する反応でした。一方、NBSを用いれば臭素原子を付加させることもできます。
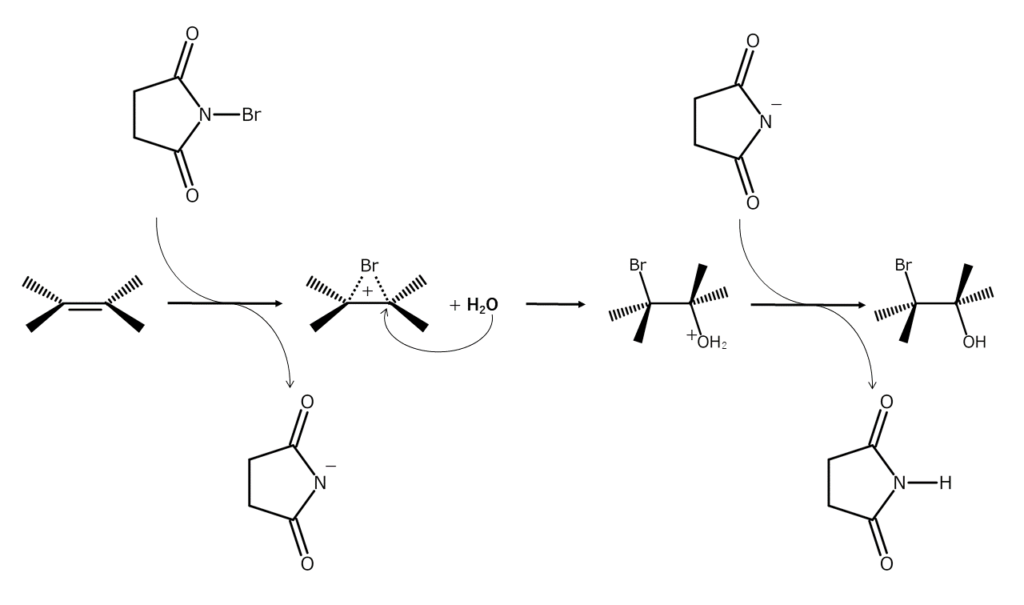
NBS中の窒素原子は、電子求引性のカルボニル基と隣接しています。そのため、NBS中の臭素原子は正に分極しており、電子が豊富な化合物に対して求電子的に作用します。今回ご紹介する「アルケンの臭素付加やブロモヒドリン化」は、Lewis酸の存在下や極性溶媒中で、NBS中の臭素原子がアルケンの二重結合に付加する反応です(求電子付加反応)。
本反応は、臭素原子上に正電荷をもつ3員環のブロモニウムイオン中間体(元の二重結合における2つの炭素原子に臭素が橋かけした構造)を経由するイオン機構で進行します。NBSの求電子攻撃によりブロモニウムイオンが生成した後、別の求核剤(水やアルコールなど)の攻撃を受けて、ブロモヒドリン(求核剤が水の場合)やそのエーテル(求核剤がアルコールの場合)が生じるのです。
ブロモニウムイオン中の臭素原子は立体的に大きいため、ブロモニウムイオンは臭素原子の反対側からのみ求核攻撃を受けることができます。そのため、通常は1,2-trans配置をもつ付加体が得られます。
単純なアルケンに対する付加反応は低温で容易に進行しますが、不飽和炭素上に電子求引基をもつ(電子不足な)アルケンの場合は、加熱や触媒の添加が必要です。また、付加-脱離反応が競争的に起こり、オレフィン炭素が臭素化されたアルケンが一緒に生じる場合もあります。
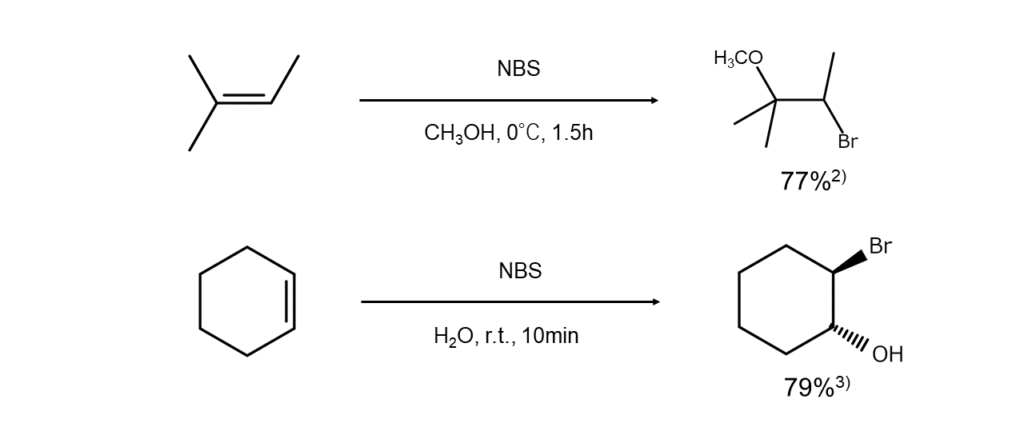
以下に、NBSを用いたアルケンの臭素化やブロモヒドリン化の反応例を示します。
【マナックこぼれ話】NBSを使えば複雑な化合物を生成できる
アルケンの臭素付加反応にNBSを使用すれば、二重結合中の一方の炭素原子には臭素原子を、他方の炭素原子にはBr以外の置換基(OHやORなど)を付加させることができます。付加生成物は1つの分子中に異なる置換基を有するため、この生成物をより複雑な化合物に誘導することも可能です。
一方、臭素化剤としてNBSではなく臭素(Br2)を用いた場合、臭素から発生した臭化物イオンもブロモニウムイオンに対して求核攻撃できてしまうため、両方の炭素原子に臭素原子が付加した生成物が得られる場合もあります。
最終的により複雑な化合物を得たい場合は、NBSを使用した臭素化がおすすめです。
NBSを用いた臭素化反応:アルコールからブロモアルカンの合成
反応の詳細
NBSをジメチルスルフィド(DMS)と混合すると、両者の付加体であるスルホニウム錯体が発生します。このスルホニウム錯体は、アリル位およびベンジル位のヒドロキシ基(OH基)を、穏やかな条件下で臭素原子に置換できます。この際、不飽和結合は影響を受けません。
本反応の反応機構を以下に示します。
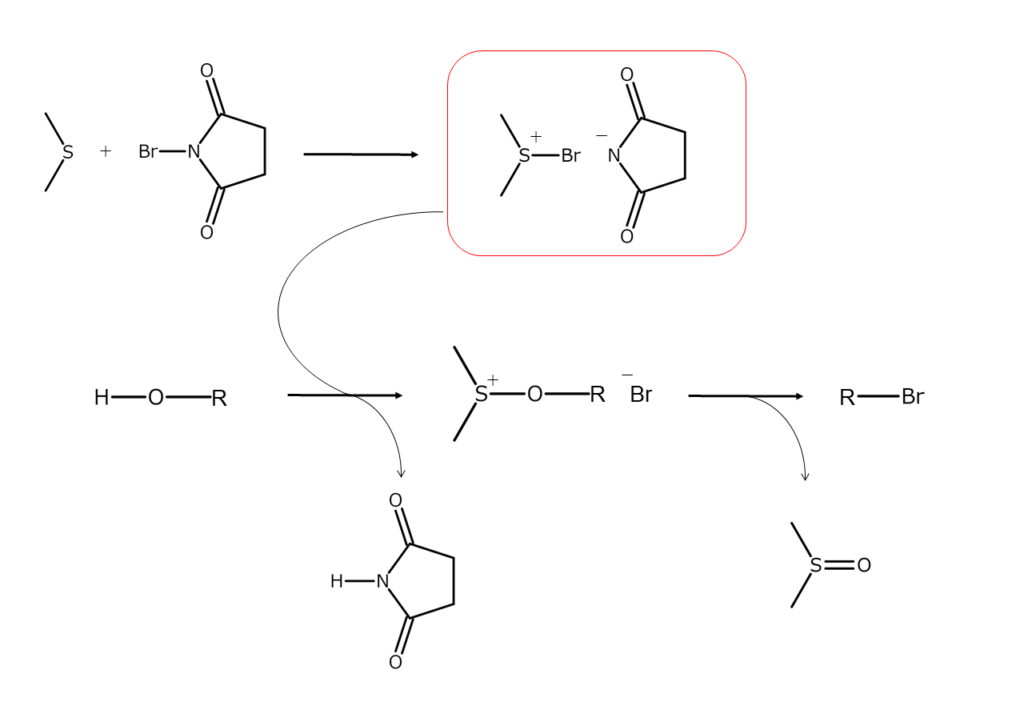
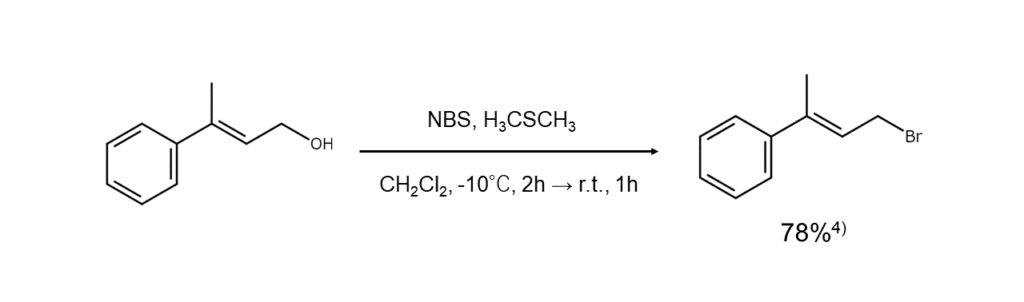
以下に、上記の反応機構でアルコールからブロモアルカンを合成する例を示します。
マナックは、代表的なN-ブロモ化合物であるNBSおよびDBDMHを製造・販売しています。ぜひ、お気軽にお問い合わせください。
参考文献
1) 鈴木仁美 監修、マナック(株)研究所 著、「臭素およびヨウ素化合物の有機合成 試薬と合成法」、丸善出版
2) Winstein, S., Ingraham, L. L. J. Am. Chem. Soc., 1952, 74, 1160.
3) Guss, C. O., Rosenthal, R. J. Am. Chem. Soc., 1955, 77, 2549.
4) Murphy, J. A., Patterson, C. W. J. Chem. Soc., Perkin Trans. 1 1993, 405.