臭化水素を用いた臭素化反応(アルコールからブロモアルカンの合成、エーテルやラクトンの開裂によるブロモアルカンの合成):臭化水素②:臭素化・ヨウ素化反応解説シリーズ 35
マナックが得意とする臭素化・ヨウ素化反応について解説する本シリーズは、前回から「臭化水素を用いた臭素化反応」に入っています。
前回の記事では臭素化反応の特徴や反応例を説明した後、試薬である臭化水素および臭化水素酸の性質や注意点を解説しました。前回の記事を読めば、臭化水素を用いた臭素化反応の全体像を理解できるはずです。
今回からは、いよいよ各臭素化反応のくわしい解説が始まります。初回は、「アルコールからブロモアルカンの合成」と「エーテルやラクトンの開裂によるブロモアルカンの合成」です。反応のちょっとしたコツも多数紹介しているので、ぜひ実験の参考にしてください。
contents
臭化水素を用いた臭素化反応:アルコールからブロモアルカンの合成
反応機構
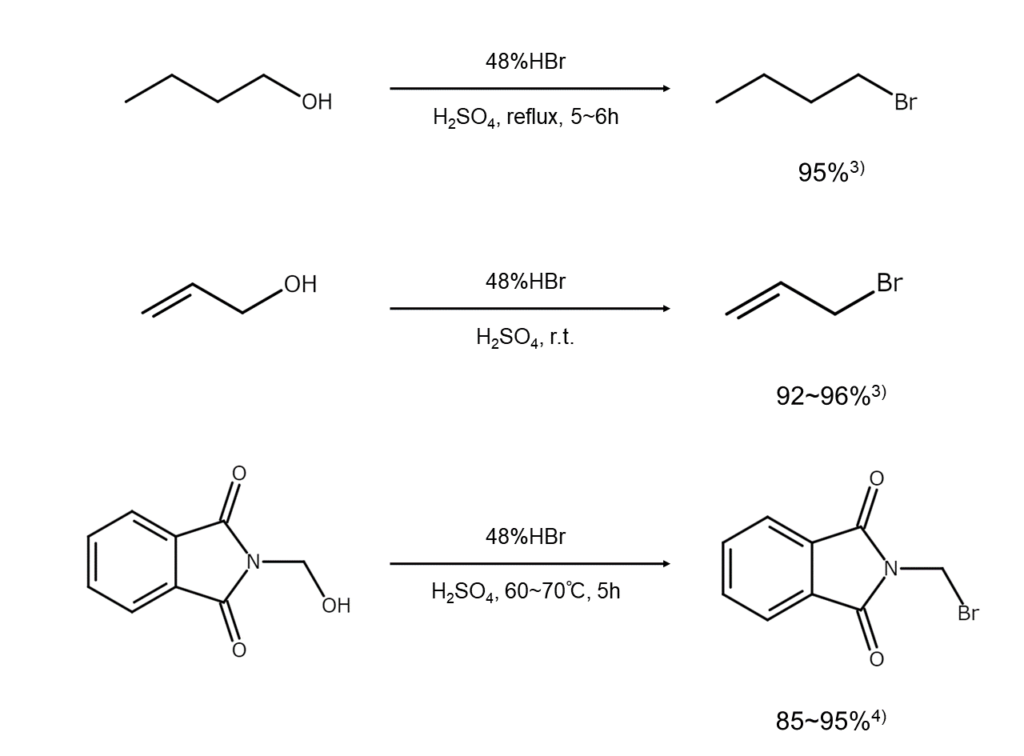
アルコールと臭化水素および臭化水素酸との反応は、ブロモアルカンを簡便に合成するための代表的な方法です。
第一級アルコールの場合は、アルコールのプロトン化で生じたオキソニウムイオンに臭素イオンが求核攻撃することで反応が進みます(以下の式(1))。一方、第三級アルコールの場合は安定なカルボカチオンを経由して反応が進行します(以下の式(2))。第二級アルコールでは両方の機構で反応する可能性があり、どちらの反応機構が優勢となるのかは反応条件に応じて変わります。
ROH + H+ → [R-O+H2] + Br– → RBr + H2O 式(1)
[R-O+H2] → R+ + H2O R+ + Br– → RBr 式(2)
アルコール中のヒドロキシ基の近くにハロゲン、ニトロ、シアノ、カルボキシなどの電子吸引基が存在するとプロトン化が起こりにくくなり、臭素化が不完全になりやすいので注意が必要です。
アルコールの級数に応じて反応条件を変える
第一級および第二級アルコールの場合は、臭化水素酸と穏やかに加熱して反応を進めるのが普通です。一方、第三級アルコールやアリルアルコール、ベンジルアルコールなどの場合は、試薬と混合して室温でかき混ぜるだけで臭化物の油層が分離してきます。
異性化や脱離反応には注意が必要
反応の進行が遅い場合、触媒として少量の濃硫酸やZnBr2を加えたり、反応系へNaBrを加えて臭素イオン濃度を高めたりするとよい結果が得られます。しかし、第三級アルコールの場合は、このような処理がときに異性化や脱離反応の原因となるため注意が必要です。
例えば、t-ブチルアルコールと臭化水素酸の反応を加熱条件下で行うと、生成した2-ブロモ-2-メチルプロパンが部分的に異性化して1-ブロモ-2-メチルプロパンとの4:1混合物に変わります2)。このような心配がある基質に関しては、安定な有機溶媒に溶かした後に乾燥した臭化水素ガスを低温で吹き込む方法や、相間移動触媒(PTC)を用いた二相系の反応により好結果を得られるケースが多いようです。
以下に、アルコールからブロモアルカンを合成する反応例を示します。
臭化水素を用いた臭素化反応:エーテルやラクトンの開裂によるブロモアルカンの合成
反応機構
エーテルは臭化水素や臭化水素酸の作用で開裂して、ブロモアルカンとアルコールを与えます。この反応は、エーテル酸素のプロトン化で生じたオキソニウムイオンに臭素イオンが求核攻撃することで進行します(以下の式(3))。しかし、ベンジルエーテルやアリルエーテル、第三級アルキルエーテルの場合は安定なカルボカチオンが容易に発生するため、カルボカチオンが臭素イオンに捕捉される機構で反応が進行します(以下の式(4))。
ROR’ + H+ → [R-O+H-R’] + Br– → RBr + R’OH 式(3)
[R-O+H-R’] → R+ + R’OH R+ + Br– → RBr 式(4)
硫酸、CuBr、臭化テトラアルキルアンモニウムなどの試薬を添加すれば、上記反応を促進させることも可能です。固体のエーテルに対しては、臭化水素酸よりも臭化水素を飽和させた酢酸を使用する方がよい結果が得られます。
基質によって生成物はさまざま
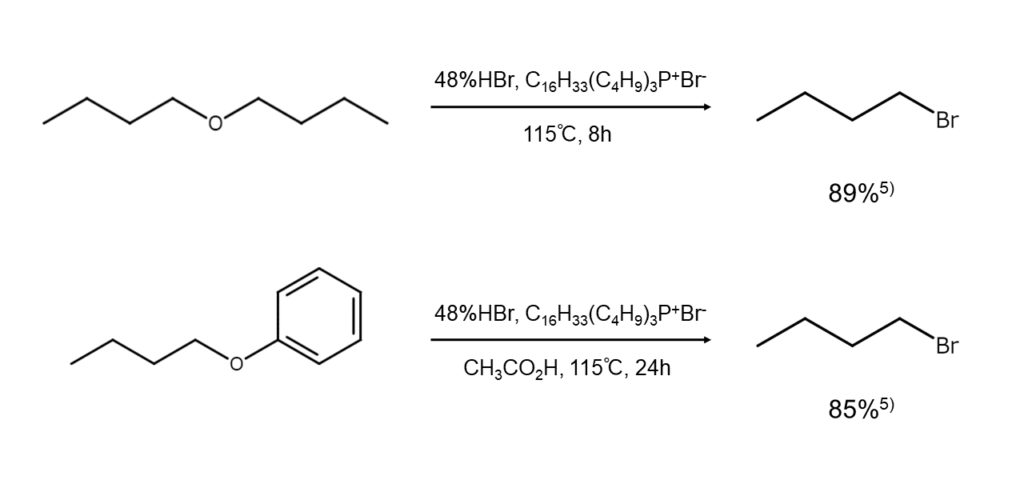
第一級または第二級アルキル基のみからなる非対称エーテルを開裂させるとブロモアルカンの混合物が得られ、その組成は反応条件によってかなり変動します。また、分岐アルキル基RをもつメチルエーテルROCH3の場合はCH3Brが優先的に生成し、芳香族エーテルArORからはRBrのみが得られます。
基質によっては、臭化水素以外を試薬とした方がよい結果が得られることもあります。例えば、芳香族エーテルの臭素化開裂には臭化アルミニウムAl2Br6やBBr3が優れています。また、環状エーテルの開裂には臭化アセチルCH3C(=O)Brも使用できますが、高温加熱が必要です。
以下に、エーテルの開裂によるブロモアルカンの合成例を示します。
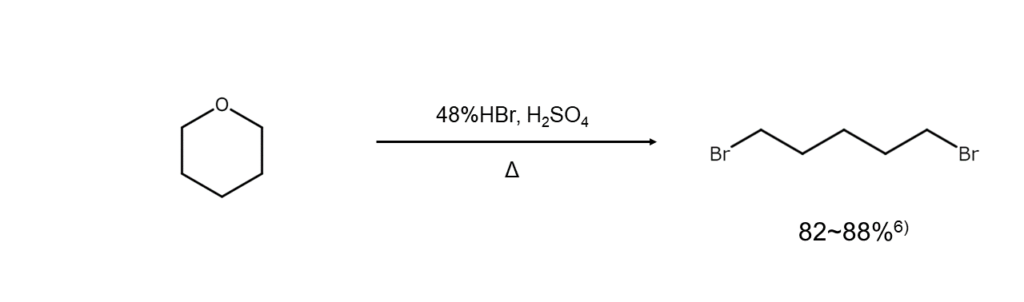
環状エーテルの臭素化開裂
臭化水素酸による環状エーテルの開裂では、試薬の量比を適当に調節することで、ω-ブロモアルコールまたはα,ω-ジブロモアルカンが得られます。以下は、α,ω-ジブロモアルカンが得られる反応例です。
続いて、環状エーテルの代表例であるエポキシドの開裂反応を取り上げましょう。非対称エポキシドの臭素化開裂では、置換基の少ない側の炭素原子が優先的に臭素化されます。また、エポキシシクロアルカンの臭素化開裂はアキシアル基から起こるため、常にtrans-2-ブロモシクロアルカノールが主生成物となります。
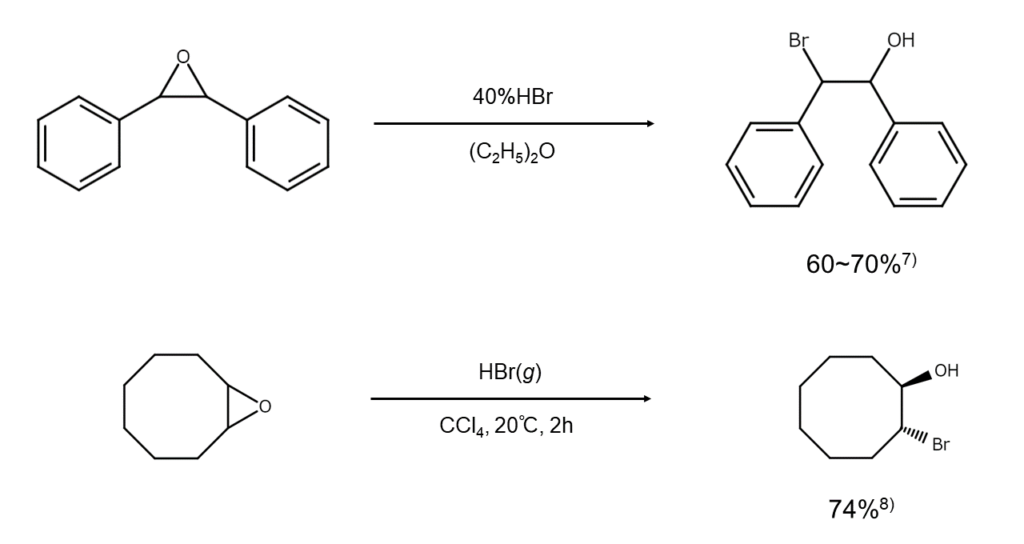
エポキシドは酸に対して敏感なので、分解または副反応が懸念される場合は、臭化水素の代わりにMgBr2を用いるのも一手です。
【コラム】エポキシドと同じように臭素化開裂する、アジリジンとは
今回の記事では、環状エーテルの一種であるエポキシドの臭素化開裂反応を解説しました。非対称エポキシドやエポキシシクロアルカンなど、さまざまなエポキシドの反応性を理解できたのではないでしょうか。
実は、臭素化開裂するときにエポキシドと同様の反応性を示す化合物があります。それが、「アジリジン(エチレンイミン)」です。
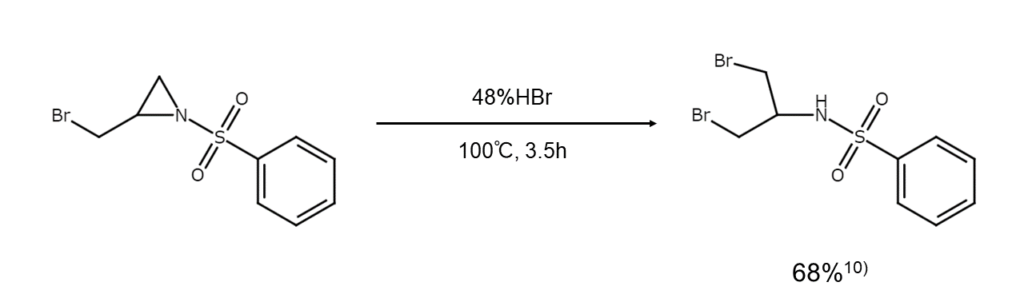
例えば、非対称アジリジンを臭化水素で臭素化開裂すると、置換基の少ない側の炭素原子が優先的に臭素化されます。これは非対称エポキシドと同じ傾向です。
【非対称エポキシドの臭素化開裂反応】
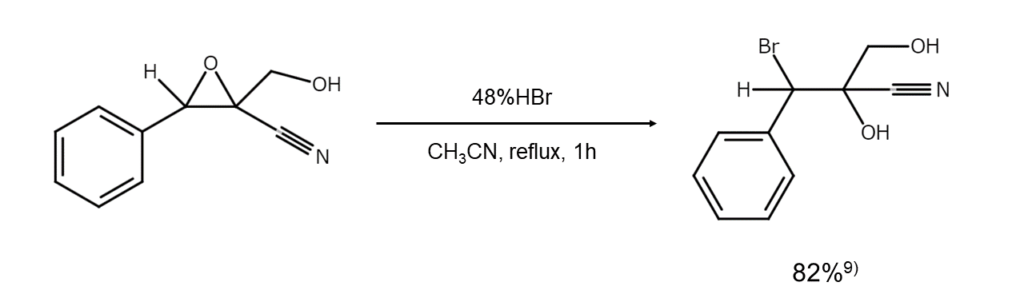
【非対称アジリジンの臭素化開裂反応】
エポキシドとアジリジン。環状エーテルの臭素化開裂反応を扱う際には、「似たもの同士」の彼らをぜひ思い出してくださいね。
マナックは、臭素化・ヨウ素化反応における世界的なリーディングカンパニーです。臭素化・ヨウ素化反応にお困りの方は、お気軽にお問い合わせください。
参考文献
1) 鈴木仁美 監修、マナック(株)研究所 著、「臭素およびヨウ素化合物の有機合成 試薬と合成法」、丸善出版
2) Michael, A., Sharf, E. et al. J. Am. Chem. Soc., 1916, 38, 653.
3) Kamm, O., Marvel, C. S. Org. Synth. Coll. Vol. 1, 25 (1941).
4) Davidsen, S. K., Phllips, G. W. et al. Org. Synth. Coll. Vol. VIII, 451 (1993).
5) Landini, D., Montanari, F. et al. Synthesis, 1978, 771.
6) Cason, J., Wallcave, W. et al. J. Org. Chem., 1949, 14, 37.
7) Reulos, D. Compt. rend., 1943, 216, 774.
8) Cope, A. C., Johnson, H. E. J. Am. Chem. Soc., 1957, 79, 3889.
9) Layachi, K., Aries-Gautron, I. et al. Tetrahedron, 1992, 48, 1585.
10) Gensler, W. J. J. Am. Chem. Soc., 1948, 70, 1843.