臭化リンを用いた臭素化反応(臭化リン(V)、臭化ホスホリル):臭化リン③:臭素化・ヨウ素化反応解説シリーズ41
マナックが得意とする臭素化・ヨウ素化反応について解説する本シリーズは、「臭化リンを用いた臭素化反応」に入っています。
今回取り上げるのは、『「臭化リン(V)」や「臭化ホスホリル」を試薬とする反応』です。これまで解説した「臭化リン(III)を試薬とする反応」や「臭素とリンによる反応」などと確認すれば、臭化リンによる臭素化反応の全体像が見えてくるはずです。
臭素化反応に関する知識をアップデートするためにも、ぜひ最後までご覧ください。
contents
臭化リンを用いた臭素化反応:臭化リン(V)を試薬とする反応
臭化リン(V)とは
臭化リン(V)(PBr5)は湿った空気中で発煙する結晶性の固体です。黄色と赤色の2種類が存在しますが、前者が一般的です。加熱すると83.8℃から昇華が始まり、明確な融点を示さずに100℃あたりで赤色の液体に変化します。湿気に弱いため、アンプルに入れて封じるか、不活性ガスの雰囲気下で暗所に保存する必要があります。
水に入れると激しく反応して臭化水素を発生し、臭化ホスホリルPOBr3またはリン酸H3PO4を与えます。しかし、ベンゼン、四塩化炭素、ジクロロエタン、二硫化炭素などには分解せずに溶解します。有毒で腐食性が強く、蒸気は皮膚や粘膜を侵すため、取り扱いには注意が必要です。
反応性に富む化合物には適用が難しい
PBr5は反応条件に応じて、オニウム塩([PBr4]+[PBr6]–)または臭素付加体(PBr3・Br2)としての挙動を示します。ただし、100℃超ではPBr5 ⇄PBr3 + Br2という解離反応が顕著になり、遊離した臭素による酸化、脱水素、臭素化などを経て樹脂化が起こりやすくなります。したがって、反応性に富む化合物には適用が難しく、目的の臭素化合物の収率は一般に高くありません。
臭化リン(V)の代わりとして使える化合物もある
PBr5は比較的高価なので、代わりに氷冷下でPCl3へ等モルの臭素を作用させて得られる結晶性のリン(V)化合物が試薬として用いられる場合もあります。この化合物にはしばしばPCl₃Br₂の化学式が与えられますが、単一の物質とはみなされていません。2)3)
臭化リン(V)が利用される反応例
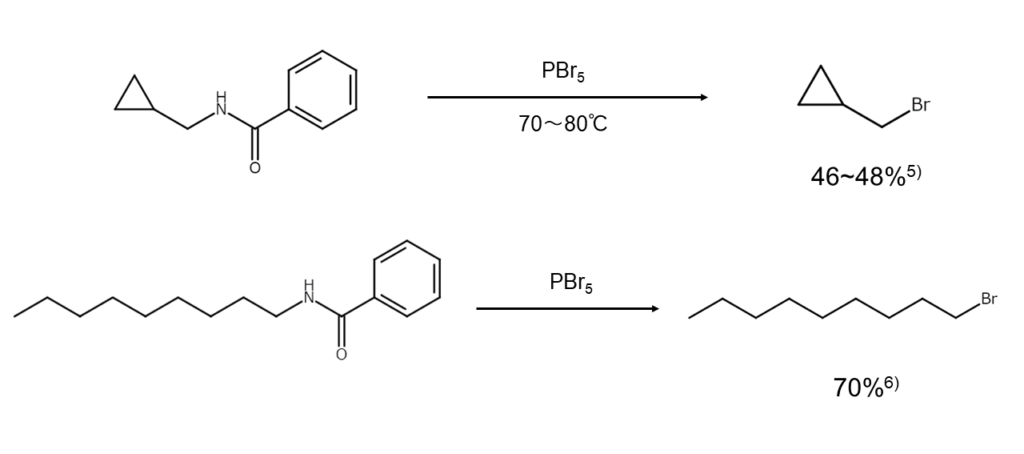
脂肪族アミンからブロモアルカンを得る「von Braun反応」
PBr5を使ってブロモアルカンを得る方法として古くから有名なのが、「von Braun反応」です。直鎖の脂肪族アミンRNH2をN-ベンゾイル化したのち、PBr5でイミドイルブロミドRN=CBrC6H5に変え(以下の式(1))、これを熱分解してブロモアルカンRBrとベンゾニトリルC6H5CNを得ます(以下の式(2))4)。
RNHC(=O)C6H5 + PBr5 → RN=CBrC6H5 + POBr3 + HBr 式(1)
RN=CBrC6H5 → RBr + C6H5CN 式(2)
von Braun反応の代表例を以下に示します。
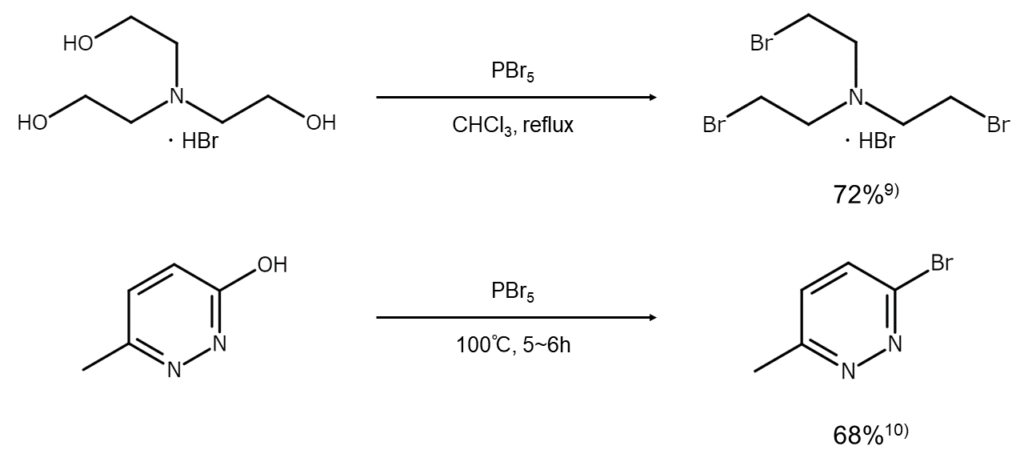
その他の反応例
PBr5は通常、芳香環やヘテロ芳香環のヒドロキシ基を臭素原子で置換する反応や、アルデヒドを1,1-ジブロモアルカンへ変換する反応に使われます。反応性はPBr3より高いものの、PBr3のようにアルコールからブロモアルカンへの変換に利用されることはあまりありません。しかし、障害構造をもつアルコールや、電子求引基で不活性化されてPBr3とうまく反応しないアルコール(ポリフルオロアルコールやニトロアルコールなど)を臭化物に変換する際にはきわめて有効です7)。
ケトンをgem-ジブロミドに変換する際にもPBr5が利用されますが8)、α位の臭素化やアルドール縮合を起こしやすいため、PCl5と同様の感覚で使用しないよう注意してください。
PBr5による臭素化の反応例を以下に示します。
臭化リンを用いた臭素化反応:臭化ホスホリルを試薬とする反応
臭化ホスホリルとは
臭化ホスホリル(POBr3)は刺激臭をもつ無色~微黄色の固体で、エーテル、ベンゼン、クロロホルム、四塩化炭素、二硫化水素に溶けます。また、水で容易に加水分解されて臭化水素酸とリン酸に変化します。催涙性があり、皮膚や粘膜を侵すため触れてはいけません。
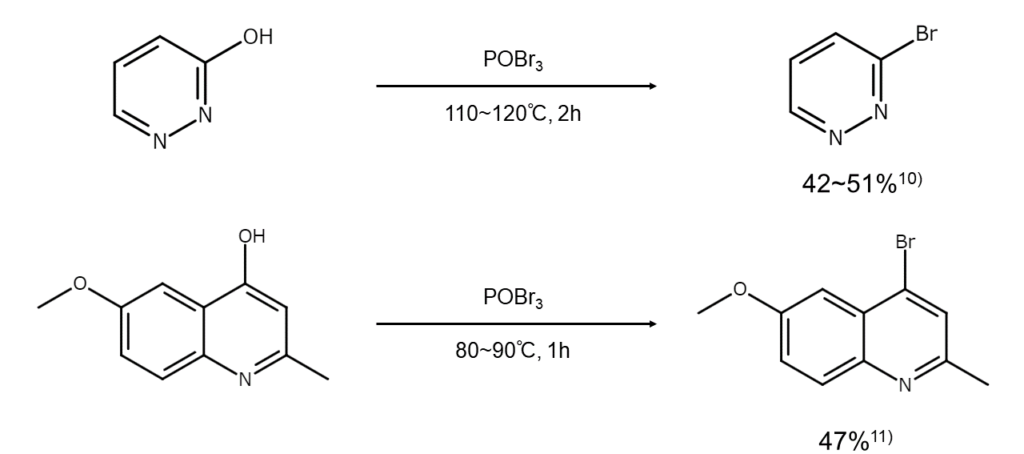
ヒドロキシ基を臭素原子で置換する反応に利用される
POBr3は、芳香環やヘテロ環のヒドロキシ基を臭素原子で置換する際に利用されます。臭素化能力はPBr5ほど高くないため、無難な試薬と言えるでしょう。一般には基質をトルエンまたはキシレンに溶かし、過剰のPOBr3を加えてHBrが発生しなくなるまで110~160℃に加熱して反応させます。
POBr3を用いた臭素化合物の合成例を以下に示します。
【コラム】PBr3とPBr5は似ているようで違う! 主な違いを解説
以前の記事で紹介した臭化リン(III)(PBr3)と、今回紹介した臭化リン(V)(PBr5)。どちらもリンと臭素からできていますが、実は両者には多くの違いがあります。主な違いは以下のとおりです。
| PBr3 | PBr5 | |
| 常温・常圧での状態 | 無色の液体 | 赤色or黄色の結晶性固体 |
| 構造 | 三角錐形の分子 | [PBr4]+Br–構造のイオン結晶(固体状態) (※[PBr4]+は四面体構造) |
| 安定性 | PBr5よりも安定 | PBr3よりも不安定 (※100℃超ではPBr3とBr2に分解する) |
特に興味深いのは構造の違いです。PBr3は三角錐形の分子ですが、PBr5は固体状態において[PBr4]+Br–構造のイオン結晶として存在します。
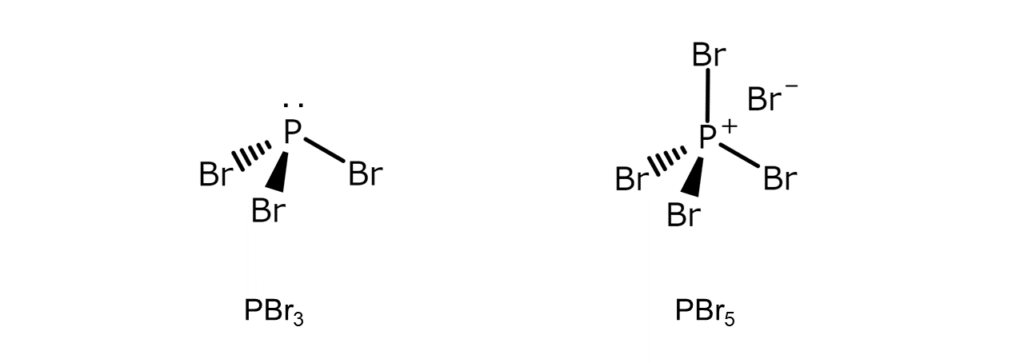
化学式は似ているのに、常温常圧での構造が全く違うPBr3とPBr5。これらはまさに、「化学の不思議を体現した」物質と言えるかもしれませんね。
参考文献
1) 鈴木仁美 監修、マナック(株)研究所 著、「臭素およびヨウ素化合物の有機合成 試薬と合成法」、丸善出版
2) Popov, A. I., Geske, D. H. et al. J. Am. Chem. Soc., 1956, 78, 1793.
3) Harris, G. S., Payne, D. S. J. Chem. Soc., 1956, 4613.
4) von Braun, J. Org. Synth. Coll. Vol. I, 428 (1941).
5) Arvin, J. A., Adams, R. J. Am. Chem. Soc., 1928, 50, 1983.
6) von Braun, J., Irmisch, G. Chem. Ber., 1932, 65, 880.
7) Eliel, E. L., Haber, R. G. J. Org. Chem., 1959, 24, 143.
8) Kutyrev. A. A., Biryukov, V. V. et al. Tetrahedron, 1990, 46, 4333.
9) Childs, A. F., Goldsworthy, L. J. et al. J. Chem. Soc., 1948, 2174.
10) Grundmann, C. Chem. Ber., 1948, 81, 1.
11) Slater, R. H. J. Chem. Soc., 1931, 107.