ベンジル位の臭素化、芳香環の臭素化:DBDMHを用いた臭素化反応:N-ブロモ化合物⑨:臭素化・ヨウ素化反応解説シリーズ 9
マナックが得意とする、臭素化・ヨウ素化反応について解説する本シリーズ。NBSの弱点を克服できる魅力的な臭素化剤、DBDMHを紹介します。
DBDMHの特徴は、代表的な臭素化剤であるNBSと似た反応性を示しつつも、NBSよりも臭素化コストや副生物の量を抑えられる点です。DBDMHはNBSほどの知名度はありませんが、知る人ぞ知る臭素化剤として、さまざまな分野で活躍しています。
ここまでの内容を読んで、「これまではNBSを使っていたけど、DBDMHも使ってみたい!」「DBDMHの特徴をもっと知りたい!」と思われた方も多いのではないでしょうか。
今回の記事では、DBDMHを使用した2種類の反応を解説します。ベンジル位を臭素化する反応と、芳香環を段階的に臭素化する反応です。反応機構や反応例をくわしく解説しますので、ぜひ研究や実験に役立ててください。
■ この記事でわかること ✔ DBDMHを使えば、芳香環に隣接するメチル基やメチレン基を選択的に一臭素化できる ✔ トリメチルシリルトリフレートを共存させることで、DBDMHの反応性が向上し、通常は反応しない安息香酸エステルなども容易に臭素化できる ✔ 触媒の種類で臭素化反応が異なり、ルイス酸ではベンジル位、ブレンステッド酸では芳香環の臭素化が進行する ■ おすすめ記事 ・ アルケンへの付加反応を起こしやすい臭素化剤、N-ブロモアセトアミド(NBA)の概要と反応機構:N-ブロモ化合物⑩:臭素化・ヨウ素化反応解説シリーズ 10 ・ コストや副生物を抑えられる魅力的な臭素化剤、1,3-ジブロモ-5,5-ジメチルヒダントイン(DBDMH)とは:N-ブロモ化合物⑧:臭素化・ヨウ素化反応解説シリーズ 8
contents
1,3-ジブロモ-5,5-ジメチルヒダントイン(DBDMH)とは
NBSと同様の反応性を示す、分子内に2つの臭素を有する臭素化剤
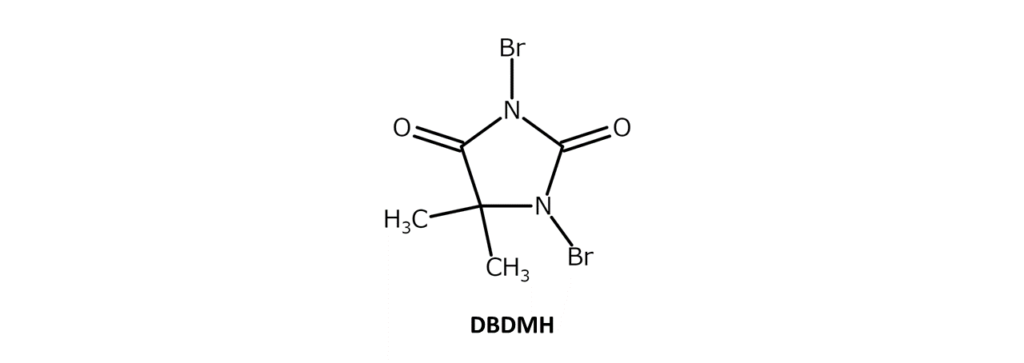
DBDMHは弱い特異臭をもつ微黄~赤黄色の結晶性粉末で、融点は197~199℃(分解)。エタノールやクロロホルムに可溶で、アセトン、ジオキサン、THF、熱水、沸騰した四塩化炭素には微溶、ヘキサンには難溶の化合物です。ジブロマンチンとも呼ばれます。
DBDMHは粉末状で、臭素(液体)と比べて取り扱いが容易なため、有機合成では臭素化剤としてよく使用されます。乾いた冷暗所で長期的に保存でき、値段も比較的安価です。反応性はNBSとほぼ同じですが、2つの臭素原子を有するためNBSに比べて臭素化コストが抑えられる点や、副生するイミドの量がNBSより少ない点が大きなメリットです。
DBDMHの特徴や注意点、DBDMHを使用した臭素化反応の概要などに関しては、こちらの記事をご覧ください。
DBDMHを用いた臭素化反応:ベンジル位の臭素化
反応の詳細
DBDMHを使えば、芳香環に隣接するメチル基やメチレン基を選択的に一臭素化できます。この反応は、NBSにおける「アリル位およびベンジル位の臭素化」と似たWohl-Ziegler型の反応で、ラジカル連鎖的に進行します。
予想される反応機構は以下のとおりです。最初に、DBDMH中のN-Br結合がラジカル的に開裂し、発生したBrラジカルがベンジル位の水素原子を引き抜くことで、ベンジルラジカルとHBrが発生します。このHBrはDBDMHの臭素原子と反応し、in situでBr2が発生します。このBr2が先ほどのベンジルラジカルと反応して、ベンジル位が臭素化されるのです。臭素化の過程で別のBrラジカルが生成されるため、反応はラジカル連鎖的に進行します。
上記の臭素化反応は、CH2(第二級炭素)>CH3(第一級炭素)>CH(第三級炭素)の順に起こりやすいことが知られています。反応の進行が遅い場合には、ラジカル発生剤(5~10%)の添加や光照射が有効なケースもあります。
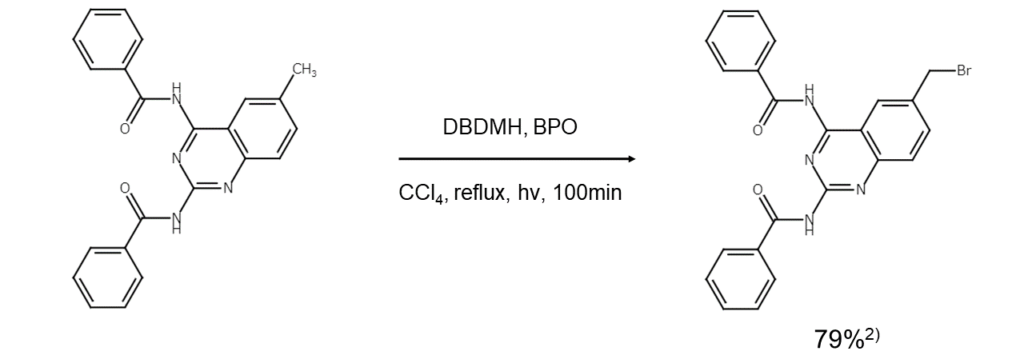
以下に、DBDMHを用いたベンジル位の臭素化反応例を示します。
DBDMHを用いた臭素化反応:芳香環の臭素化
反応の詳細
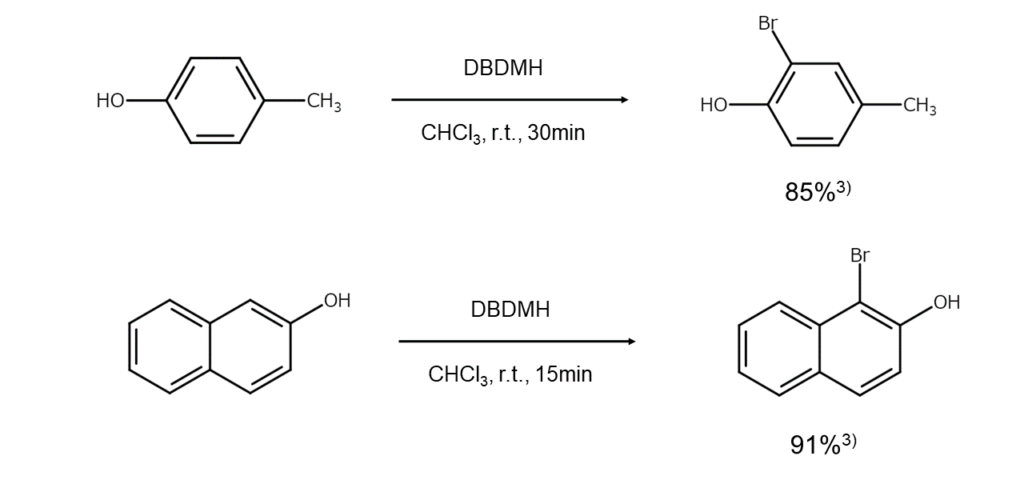
DBDMH中の窒素原子は、電子求引性のカルボニル基と隣接しています。そのため、DBDMH中の臭素原子は正に分極しており、電子豊富な化合物に対して求電子的に作用できる状態です。したがってDBDMHを使えば、電子供与基で活性化された芳香環を酸触媒の存在下で段階的に臭素化できます(芳香族求電子置換反応)。
さらに、トリメチルシリルトリフレートを共存させるとDBDMHの反応性が高まり、通常ならDBDMHと反応しない安息香酸エステルなども容易に臭素化できます。この理由についてChassaingらは、「DBDMHとトリメチルシリルトリフレートの共存下では反応中間体としてブロモニウムトリフレートが生成するため」と説明しています3)。
以下に、DBDMHを用いた芳香環の臭素化反応例を示します。
使用する触媒に応じて臭素化の位置が変化する
「ベンジル位の臭素化」と「芳香環の臭素化」のどちらが優先的に起こるかは、使用する触媒によって決まる、という研究もあります5)。
この研究では、塩化ジルコニウム(Ⅳ)などのルイス酸触媒を用いた場合は「ベンジル位の臭素化」が起こりやすく、トリフルオロメタンスルホン酸などのブレンステッド酸触媒を用いた場合は「芳香環の臭素化」が起こりやすいと報告しています。ルイス酸はベンジルラジカルの生成を助け、Wohl-Ziegler型のベンジル位の臭素化反応を促進します。一方で、ブレンステッド酸はDBDMHをプロトン化して、Friedel-Crafts型の求電子的な芳香環の臭素化反応を促進するため、このような違いが表れるそうです。

マナックは、代表的なN-ブロモ化合物であるNBSおよびDBDMHを製造・販売しています。ぜひ、お気軽にお問い合わせください。
参考文献
1) 鈴木仁美 監修、マナック(株)研究所 著、「臭素およびヨウ素化合物の有機合成 試薬と合成法」、丸善出版
2) Oakes, V., Rydon, H. N. et al. J. Chem. Soc., 1962, 4678.
3) Chassaing, C., Haudrechy, A. et al. Tetrahedron Lett. 1997, 38, 4415.
4) Alam, A., Takaguchi, Y. et al. J. Fac. Environ. Sci and Tech., Okayama Univ., 2005, 10, 105.
5) Shibatomi, K., Zhang, Y. et al. Chem Asian J. 2008, 3, 1581.