臭化水素を用いた臭素化反応(アルケンへの付加、アルキンへの付加):臭化水素③:臭素化・ヨウ素化反応解説シリーズ 36
マナックが得意とする臭素化・ヨウ素化反応について解説する本シリーズ。
今回取り上げるのは、臭化水素の「アルケンへの付加」と「アルキンへの付加」です。これらは、条件を変えるだけで同じ基質から異なる生成物が得られる非常に便利な反応です。しかし、生成物の位置選択性が低くなるケースや触媒を使用した方がよいケースもあるため、反応の設計には注意を払う必要があります。
この記事では、反応の原理や特徴、注意点などをまとめて解説します。この便利な反応を使いこなすためにも、ぜひ最後までご覧ください。
contents
臭化水素を用いた臭素化反応:アルケンへの付加
反応条件に応じて「イオン反応」または「ラジカル反応」が進行する
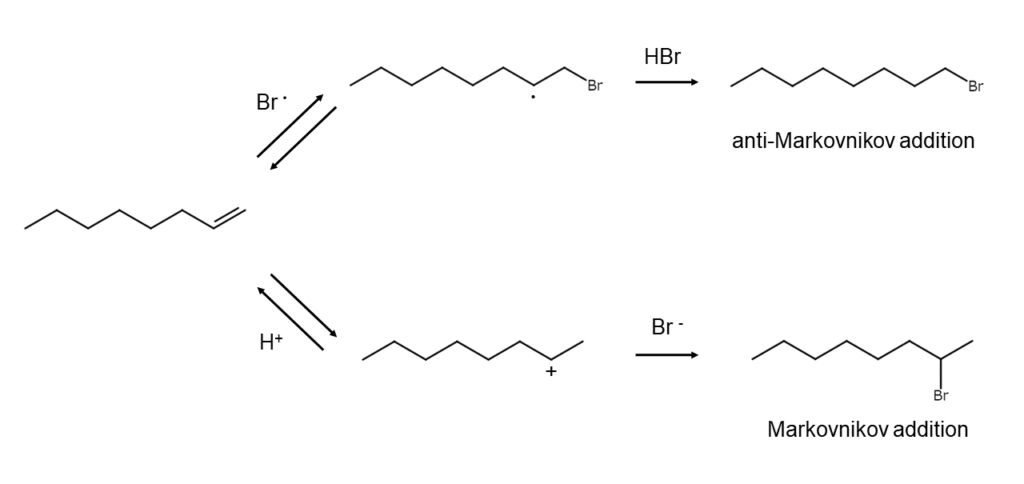
臭化水素は、室温でアルケンに付加してブロモアルカンを生成します。ただし、その反応機構は反応条件によって大きく異なります。
極性溶媒中でみられるのは、イオン反応です。臭化水素から発生したH+がアルケンの二重結合に付加してカルボカチオンを生成し、このカルボカチオンをBr–が捕捉することで付加生成物が得られます。カルボカチオンを経由するため、付加方向はMarkovnikov則にしたがい、生成するブロモアルカンの優先順位は第三級>第二級>第一級となります。
一方、無極性溶媒中で過酸化物や光を共存させた際に起こるのが、イオン反応よりもずっと速いラジカル反応です。開始剤によって発生した臭素原子Br・がアルケンに付加してブロモアルキルラジカルが生成し、このブロモアルキルラジカルが臭化水素中の水素を引き抜くことで付加生成物が得られます。より安定なブロモアルキルラジカルを経由するように反応が進行するため、イオン反応とは付加方向が逆になる点が特徴です(逆Markovnikov付加)。
電子不足型のアルケンの場合は付加反応速度が遅いため、Fe2Cl6、Fe2Br6、Al2Cl6などのLewis酸を共存させて反応を促進させる手もあります。
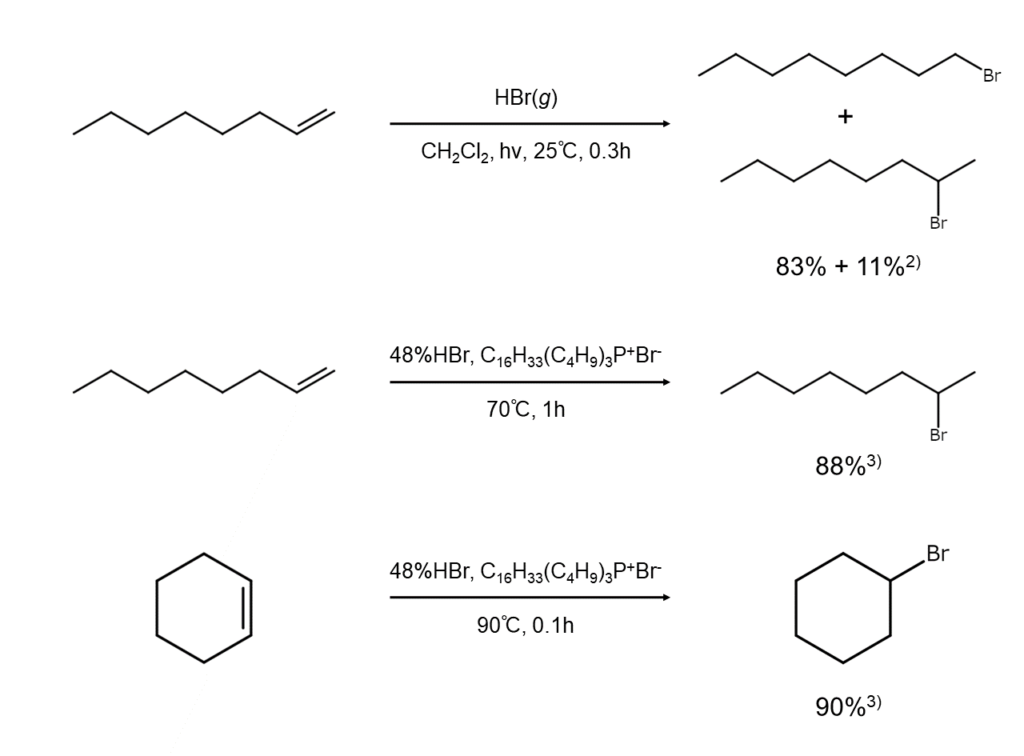
以下に、アルケンへの臭化水素の付加によるブロモアルカンの合成例を示します。
位置選択性の高さは反応条件や基質に依存する
臭化水素を用いたアルケンへの臭素付加は、反応条件を変えるだけで同じ基質と試薬から異なるブロモアルカンが得られるため、便利な合成法だと言えます。しかし、上で説明した位置選択性は完全なものではありません。例えば、逆Markovnikov付加の場合にはときに満足な位置選択性が得られないこともあります。
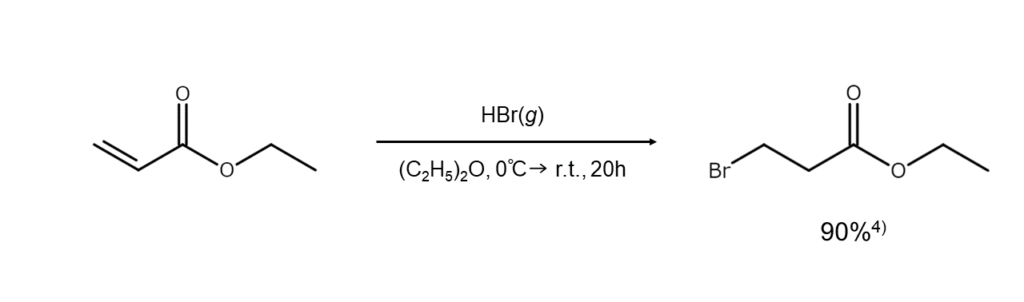
一方で、反応の位置選択性が非常に高くなる場合もあります。例えば、α,β-不飽和カルボニル化合物やα,β-不飽和ニトリルに対する臭素原子の付加はつねにβ位で起こり、β-ブロモケトンやβ-ブロモニトリルが単一の生成物として得られるのです。
特定の生成物だけを得たい場合には、位置選択性が高くなるように基質や反応条件を注意深く検討するようにしてください。
臭化水素を用いた臭素化反応:アルキンへの付加
アルキンへの付加反応はアルケンよりも遅い
アセチレン炭素はsp混成をしていることからオレフィン炭素よりもs性が高く、プロトン化されにくいため、アルキンに対するHBrの付加は一般に遅くなります。したがって、通常はCuBrや臭化テトラアルキルアンモニウムR4N+Br–を触媒として反応が行われます。
アルキンの場合もアルケンと同じように、イオン反応とラジカル反応とではHBrの付加方向に違いが現れます。しかし、アルケンの場合ほど明確ではありません。また、HBrが過剰に存在するとHBrが2回付加してgem-ジブロモ化合物が得られます。
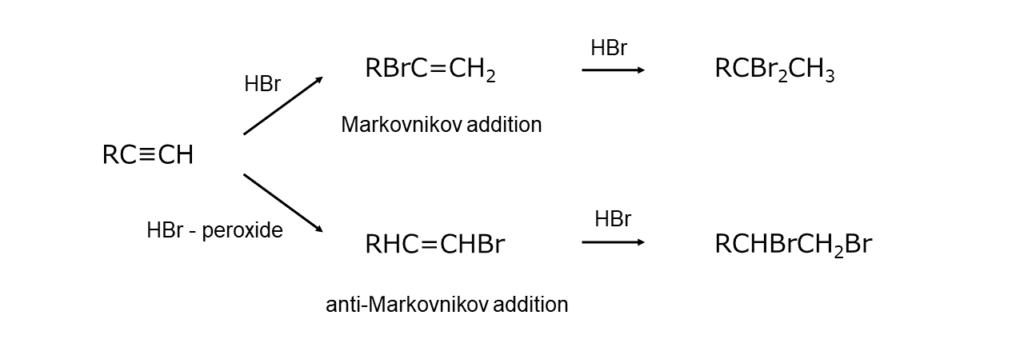
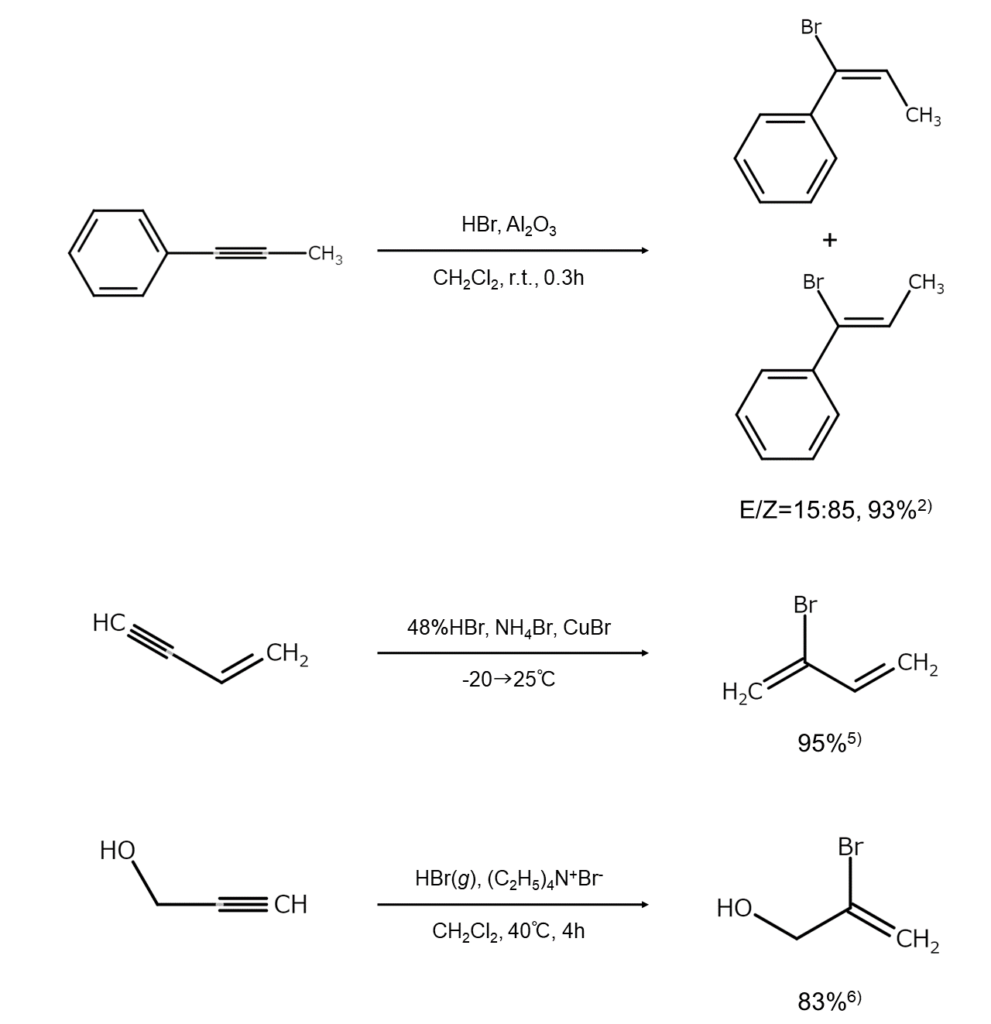
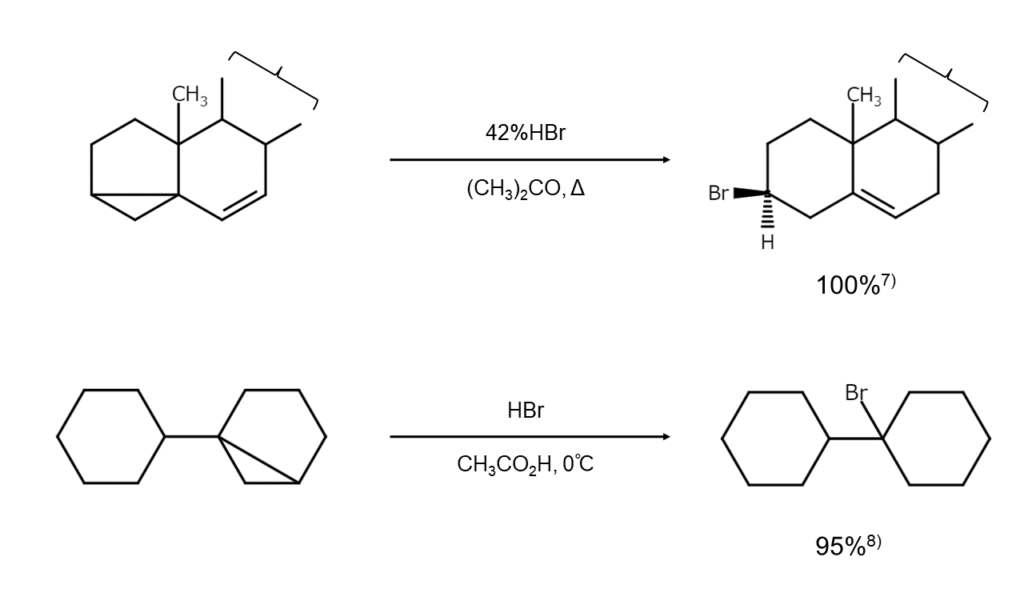
アルキンへのHBrの付加によるブロモアルケンの合成例を、以下に示します。
【コラム】まるでアルケンのように反応する! シクロプロパンへのHBr付加反応とは
今回は、不飽和炭化水素であるアルケンおよびアルキンへのHBr付加反応を解説してきました。反応条件の選定や触媒の利用など、注意すべき点をご理解いただけたかと思います。
ここで、「不飽和炭化水素ではないが不飽和炭化水素のようにHBrの付加を受ける」化合物をご紹介しましょう。それが、三員環の飽和炭化水素「シクロプロパン」です。
シクロプロパンの三員環は「バナナ結合(バナナのように曲がった形の結合)」と呼ばれる歪んだ炭素-炭素結合で構成されているため、σ結合のみからなる一般的なシクロアルカンとは異なりある程度のπ結合性を持ちます。その結果、シクロプロパンはアルケンと似た性質を示すようになり、HBrの作用で容易に開環してブロモアルカンに変化するのです。これは、他のシクロアルカンではみられない反応です。
最後に注意点です。シクロプロパンは非常に大きな歪みを持つため、化学的に不安定で反応性が高くなります。シクロプロパン構造を持つ化合物をHBrで処理する際には、反応の制御に格別の注意を払うようにしてください。
マナックは、臭素化・ヨウ素化反応における世界的なリーディングカンパニーです。臭素化・ヨウ素化反応にお困りの方は、お気軽にお問い合わせください。
参考文献
1) 鈴木仁美 監修、マナック(株)研究所 著、「臭素およびヨウ素化合物の有機合成 試薬と合成法」、丸善出版
2) Kropp, P. J., Daus, K. A. et al. J. Am. Chem. Soc., 1990, 112, 7433.
3) Landini, D., Rolla, F. J. Org. Chem., 1980, 45, 3527.
4) Mozingo, R., Patterson, L. A. Org. Synth. Coll. Vol. III, 576 (1955).
5) Keegsta, M. A., Verkruijsse, H. D. et al. Synth. Commun. 1991, 21, 721.
6) Cousseau, J. Synthesis, 1980, 805.
7) Riegel, B., Hager, G. P. et al. J. Am. Chem. Soc., 1946, 68, 2562.
8) Läber, G. Liebigs Ann. Chem., 1954, 588, 79.