カルボニル化合物のヨウ素化:脂肪族化合物のヨウ素化反応④:臭素化・ヨウ素化反応解説シリーズ 21
本シリーズではこれまで数回にわたり、単体ヨウ素を用いたアルカン、アルケン、アルキンのヨウ素化反応を解説してきました。直接のヨウ素化が困難なものや、反応の進行が遅いもの、比較的円滑に反応が進行するものなど、さまざまなパターンの反応があります。
今回の記事では引き続き、単体ヨウ素を用いたカルボニル化合物のヨウ素化反応を取り上げます。
カルボニル化合物のヨウ素化反応にはさまざまな問題があったのですが、近年、反応を円滑に進行させるための改良法がたくさん出てきています。これらの改良法を知れば、ヨウ素化反応を設計しやすくなるに違いありません。
本記事では、従来法の問題点や改良法の詳細などを解説していきます。ぜひ最後までご覧ください。
■ この記事でわかること ✔ 単体ヨウ素を用いた従来法には収率の低さや縮合物生成などの欠点があるため、NISやハロゲン交換、その他の改良法が提案されている ✔ NISはヨウ素化剤として優秀だが、ヨウ素が原料のため高価で、大量合成には不向きである ✔ NISは高反応性だがアリル位のヨウ素化ができない。一方、NBSは安価でアリル位の臭素化が可能で、使い分けが必要 ■ おすすめ記事 ・ カルボン酸と関連化合物のヨウ素化:脂肪族化合物のヨウ素化反応⑤:臭素化・ヨウ素化反応解説シリーズ 22 ・ アルキンのヨウ素化:脂肪族化合物のヨウ素化反応③:臭素化・ヨウ素化反応解説シリーズ 20
contents
単体ヨウ素による脂肪族化合物のヨウ素化反応:カルボニル化合物のヨウ素化
【従来法】収率が低い、立体障害の影響を受ける、といった欠点あり
単体ヨウ素を用いると、カルボニル化合物のα水素をヨウ素原子で置換できます。これが、今回説明する「カルボニル化合物のヨウ素化」反応です。
単体ヨウ素によるケトンのヨウ素化は、一般に、塩基の存在下でエノラートアニオンを発生させて行われます。反応機構は以下の通りです。

しかし、実はこの方法には問題があります。収率が低くばらつきが大きいうえ、縮合物をともないやすいのです。
したがって実験室では、単体ヨウ素を使う代わりに、以下2種類の方法がよく用いられています。
①ハロゲン交換を用いる方法
ハロゲン交換は、化合物中のあるハロゲン原子を別のハロゲン原子と置換する方法です。今回の場合は、α-ブロモケトンやα-クロロケトンをヨウ化アルカリと反応させて、化合物中の臭素原子や塩素原子をヨウ素原子と交換します。
しかしこの方法には、立体障害の影響を受けやすいという問題もあります。
ハロゲン交換反応についてくわしく知りたい方は、以下の記事をご覧ください。
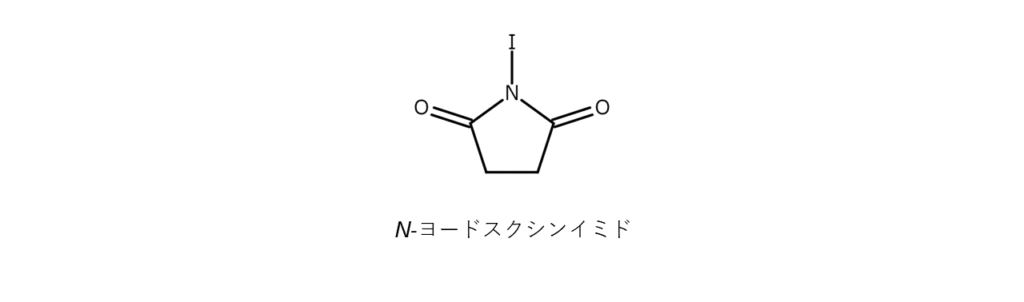
②N-ヨードスクシンイミド(NIS)を用いる方法
NISはN-ヨード化合物の一種で、ハロゲン臭をもつ白色~微黄色の結晶性粉末です。
NISを酢酸、トルエンスルホン酸、トリフルオロ酢酸のようなプロトン酸と組み合わせると、反応性に富む次亜ヨウ素酸アシルが発生します。そのため、NISは反応性の高いヨウ素化剤としてさまざまな場面で利用されており、カルボニル化合物のヨウ素化にも使用できるのです。
ただし、NISは試薬としてはやや高価なため、大量合成には適していません。
【改良法】単体ヨウ素によるヨウ素化をより円滑に行うための方法
以上のように、単体ヨウ素を用いた従来のヨウ素化法には多くの欠点がありました。しかし、単体ヨウ素の使用をあきらめるのは尚早です。実は、ヨウ素化を円滑に行うためのさまざまな改良法が検討されているのです。代表的な方法を以下に示します。
改良法①:
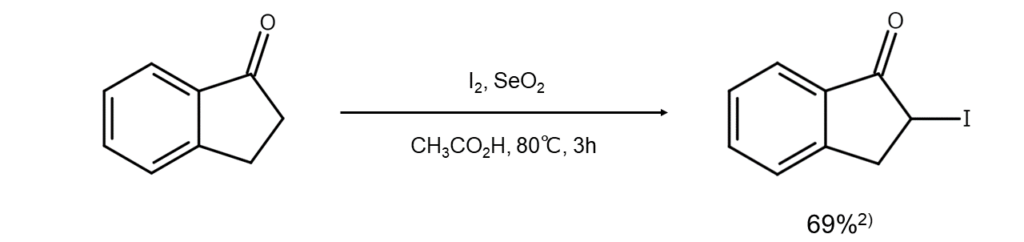
酢酸中で、ケトンを単体ヨウ素および二酸化セレンと加熱する方法です。この方法は、環状ケトンや芳香環をもつケトンでは好結果が得られています2)。
改良法②:
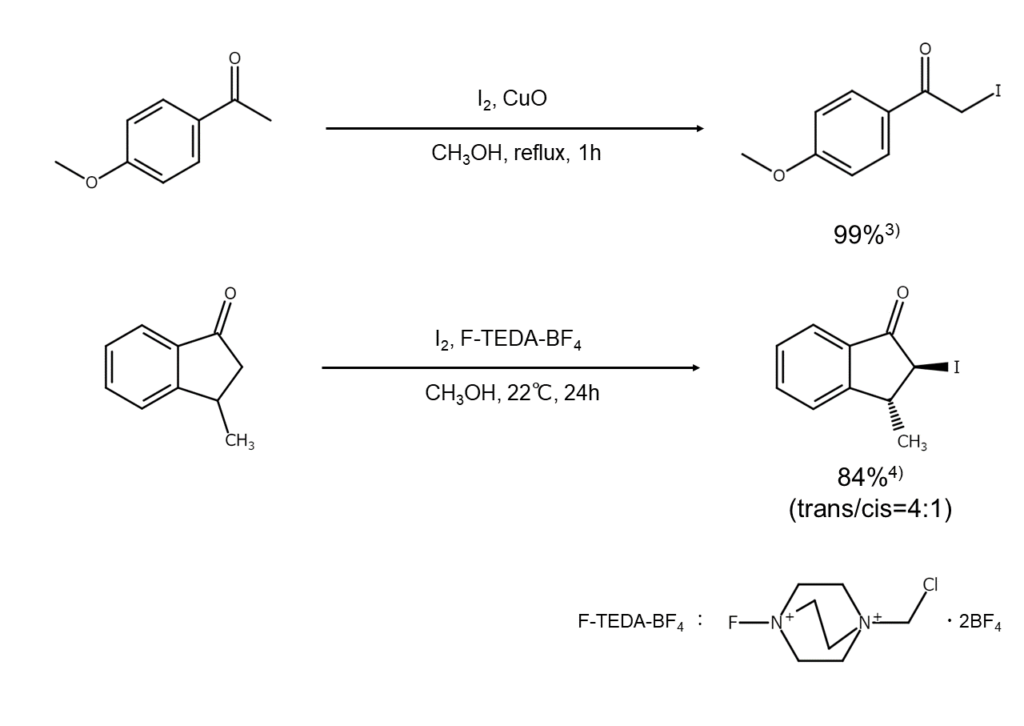
メタノール中で、ケトンを単体ヨウ素と酸化銅やF-TEDA-BF4と反応させる方法です3)4)。
改良法③:
ケトンをイソプロペニルアセタートや酢酸無水物でいったんエノールエステルに変えてから、単体ヨウ素でヨウ素化する方法です5)。
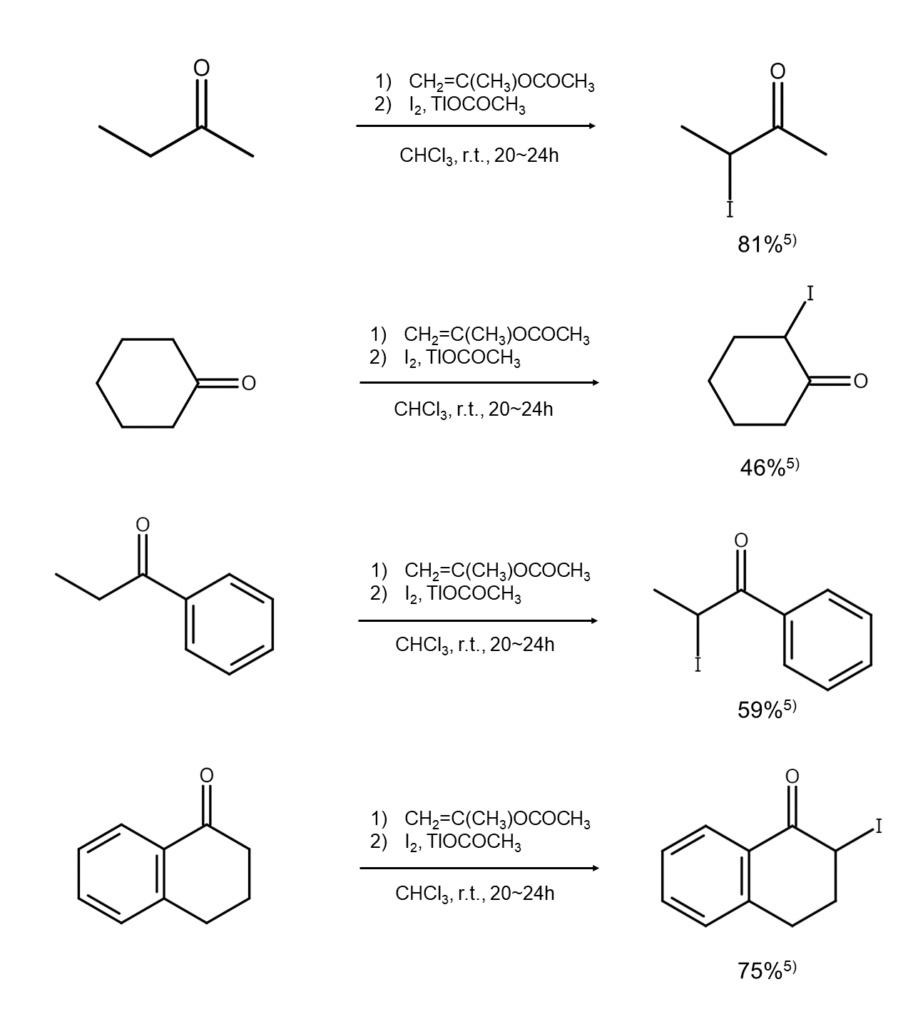
改良法④:
環状エノンのα位のヨウ素化には、ピリジンを求核的に付加させてエノラートに変え、これをヨウ素化する方法が提案されています6)。
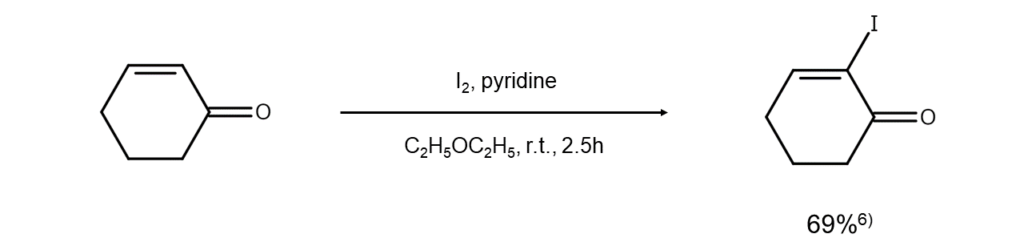
改良法⑤:
ピリジンの共存下でアルケンをヨウ素とクロム酸銀により処理すると、α-ヨードケトンが1段階で得られます。これはかなり収率のよい反応ですが、電子不足型のアルケンには適用できません7)。
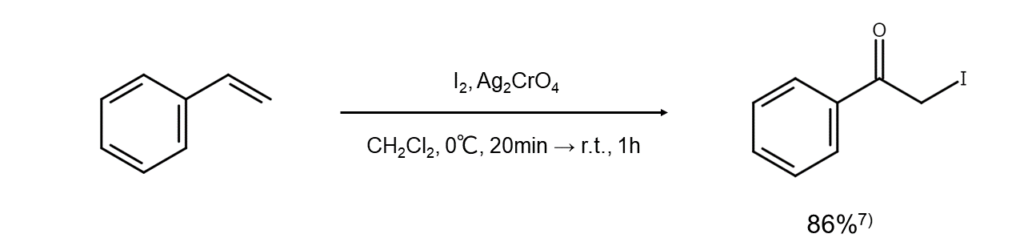
改良法⑥:
塩化水銀(II)と単体ヨウ素を使用する方法です8)。α-ヨード化合物を直接的かつ位置特異的に合成できます。
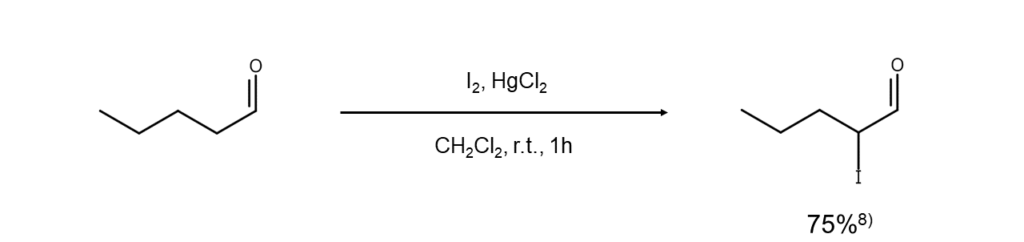
改良法⑦:
硝酸アンモニウムセリウム(IV)と単体ヨウ素を使用する方法です9)。この方法を用いると、α,α’-ジヨードケトンを収率よく得ることができます。
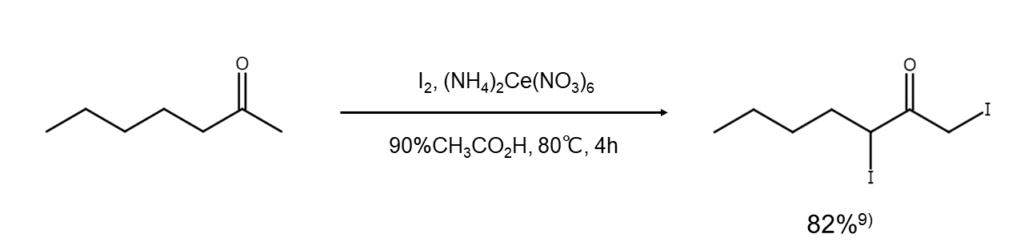
【コラム】ヨウ素化剤「NIS」と臭素化剤「NBS」、どこが違うの?
今回の記事では、カルボニル化合物のヨウ素化法の1つとして、N-ヨードスクシンイミド(NIS)を用いる方法をご紹介しました。
このNISと似た化合物に、N-ブロモスクシンイミド(NBS)があります。NBSは、NISのヨウ素原子が臭素原子に置き換わった化合物で、非常に有名な臭素化剤です。本シリーズでも以前、NBSを活用した臭素化反応を数回にわたって取り上げました。
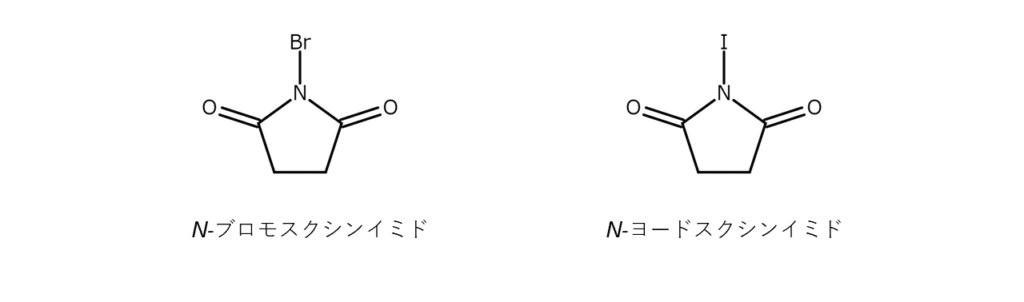
構造や用途が似ているNISとNBSですが、両者にはいくつか違いがあります。
まず、NISはNBSよりも高い反応性を示します。しかし、NBSとは異なり、光照射したり過酸化物を共存させたりしても、アリル位のヨウ素化はできません。
値段にも違いがあります。NBSは比較的安価に市販されていますが、NISは原料となるヨウ素の値段が高いため、やや高価です。
似ているけど少し違う、まるで兄弟のようなNISとNBS。彼らは、私たちの生活を陰から日々支えてくれているのです。
参考文献
1) 鈴木仁美 監修、マナック(株)研究所 著、「臭素およびヨウ素化合物の有機合成 試薬と合成法」、丸善出版
2) Bekaert A., Barberan, O. et al. Tetrahedron Lett., 2000, 41, 2903.
3) Yin, G., Gao, M. et al. Synthesis, 2007, 3113.
4) Jereb, M., Stavar, S. et al. Tetrahedron, 2003, 59, 5935.
5) Cambie, R. C., Hayward, R. C. et al. J. Chem. Soc. Perkin Trans. 1, 1978, 126.
6) Ruel, F. S., Braun, M. P. et al. Org Synth., 1997, 75, 69.
7) Cardillo, G., Shimizu, M. J. Org. Chem., 1977, 42, 4268.
8) Barluenga, J., Martinez-Gallo, J. M. et al. Synthesis, 1986, 678.
9) Horiuchi, C. A., Takahashi E. Bull. Chem. Soc. Jpn., 1994, 67, 271.