酸ヨウ化物の合成、ヨードアレーンの合成:ハロゲン交換によるヨウ素化反応③:臭素化・ヨウ素化反応解説シリーズ 14
電子材料や医薬品などの中間体として活躍しているヨウ化物は、最終製品には含まれていませんが、私たちの生活を陰から支えています。
ヨウ化物の合成法として重要なのが、ハロゲン交換です。ハロゲン交換は、比較的多くの基質をヨウ素化できる便利な方法として、古くからさまざまな場面で活用されてきました。ハロゲン交換に関する知識は、ヨウ素化反応を設計する上でも役立つことでしょう。
前回の記事では、ハロゲン交換によるヨウ素化の代名詞とも言える「ヨードアルカンの合成反応」を取り上げました。本記事では引き続き、ハロゲン交換による「酸ヨウ化物の合成反応」と「ヨードアレーンの合成反応」を取り上げます。反応機構や反応例をくわしく解説しますので、ぜひ実験の参考にしてください。
■ この記事でわかること ✔ Finkelstein反応は、酸ハロゲン化物に対しても適用できる ✔ ブロモアレーンやクロロアレーンからヨードアレーンを合成することも可能だが、芳香環上に存在する置換基の位置や特性などに応じて反応条件が異なる ✔ 超原子価ヨウ素化合物は、毒性が低く環境にやさしいため、医薬品原薬を合成する際の酸化剤として使用される ■ おすすめ記事 ・ ヨードアルカンの合成:ハロゲン交換によるヨウ素化反応②:臭素化・ヨウ素化反応解説シリーズ 13 ・ ハロゲン化試薬として使える! 超原子価有機ヨウ素化合物の概要と、ジハロゲノヨード化合物を解説:超原子価有機ヨウ素化合物①:臭素化・ヨウ素化反応解説シリーズ 29 ・ 穏やかな酸化剤として有用な(ジアシルオキシヨード)アレーン:超原子価有機ヨウ素化合物②:臭素化・ヨウ素化反応解説シリーズ 30
contents
ハロゲン交換とは
塩化物や臭化物をヨウ化物に変換する方法
ハロゲン交換は、化合物中のあるハロゲン原子を別のハロゲン原子に変換する方法です。今回の場合は、塩素原子や臭素原子をヨウ素原子に変える方法を指します。
ハロゲン交換反応にはいくつか種類があります。なかでもヨウ素化反応で主に使用されるのは、ハロゲン原子を二分子求核置換反応(SN2反応)によって別のハロゲン原子と交換する「Finkelstein(フィンケルシュタイン)反応」2)です。反応式を以下に示します。
R-X + NaI ⇌ R-I + NaX X = Cl, Br
Finkelstein反応は適用できる基質の範囲が広いため、古くからヨードアルカンなどの合成に利用されてきました。Finkelstein反応のくわしい原理に関しては、こちらの記事をご覧ください。
ハロゲン交換によるヨウ素化反応:酸ヨウ化物の合成
反応の詳細
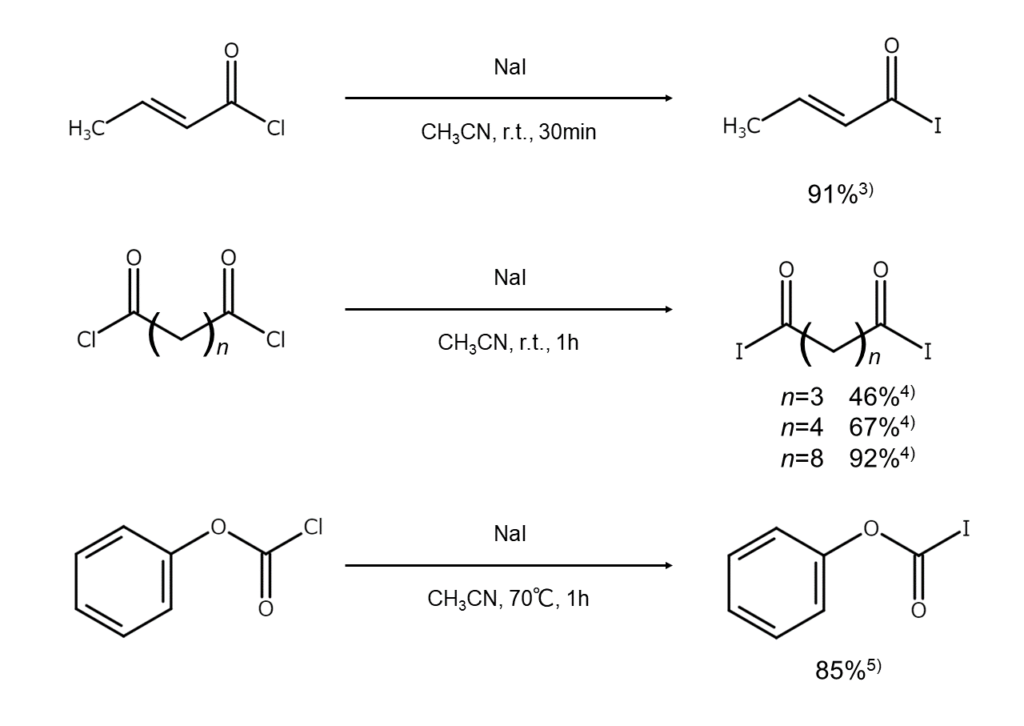
Finkelstein反応は、酸ハロゲン化物(ハロゲン化アシル)に対しても適用できます。例えば、無水アセトニトリル中で酸塩化物にNaIを作用させると、対応する酸ヨウ化物が高収率で得られます3)~5)。前回の記事で解説した「ヨードアルカンの合成」とは異なり、第三級の酸ハロゲン化物も問題なくハロゲン交換できる点がメリットです。
酸ヨウ化物は不安定なものが多いため、すぐに使い切らない場合は、少量の銅粉を加えて冷暗所に保存しましょう。
以下に、ヨウ化アルカリを用いた酸ヨウ化物の合成例を示します。
ハロゲン交換によるヨウ素化反応:ヨードアレーンの合成
反応の詳細
ハロゲン交換を活用すれば、ブロモアレーンやクロロアレーンからヨードアレーンを合成することも可能です。ただし、芳香環上に存在する置換基の位置や特性などに応じて反応条件が異なります。詳細は以下のとおりです。
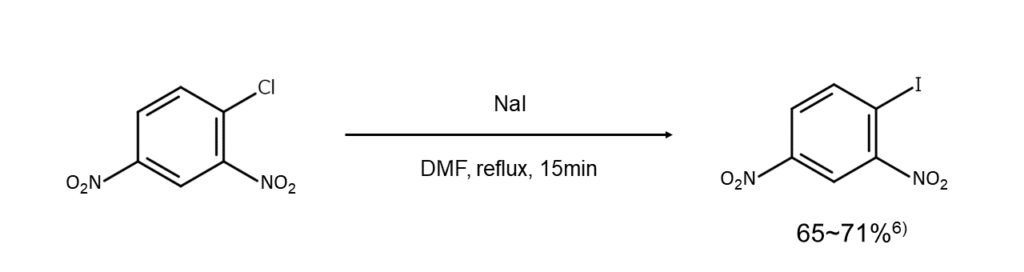
①強い電子求引基が存在する場合
ハロゲン置換基のオルト位またはパラ位に強い電子求引基(ニトロ基、カルボニル基、シアノ基など)が存在する場合、ハロゲン置換基を脱離基とするFinkelstein反応(芳香族求核置換反応)が起こりやすくなります。
例えば以下のように、極性溶媒中で4-クロロ-1,3-ジニトロベンゼンをヨウ化ナトリウムと加熱すると、対応するヨードアレーンが得られます。
また、窒素原子の影響で電子密度が小さくなるピリダジン環に対しても、以下の条件でハロゲン交換が起こります。

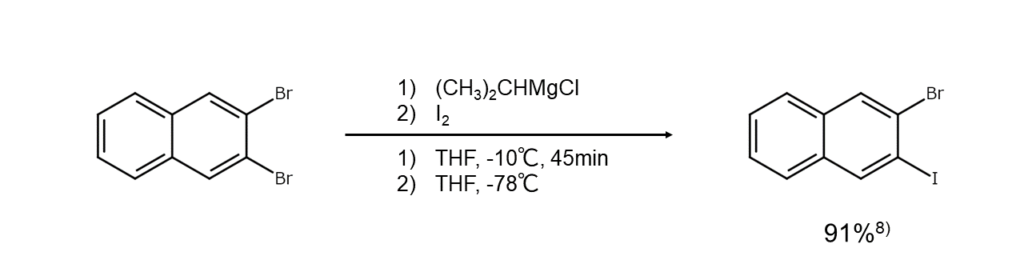
②電子供与基が存在する場合
アルキルベンゼンやフェノールエーテルのように電子供与基をもつ塩素および臭素誘導体は、芳香環上の電子密度が大きくなるため、Finkelstein反応が起こりづらくなります。
この解決策としては、反応物をいったんGrinard試薬や有機リチウムに変えてからヨウ素で処理する方法が知られています(以下の反応式を参照)。ポリハロアレーンの場合は活性化位置のハロゲン原子が優先的にMgで置換されるため、工夫次第でさまざまな置換パターンのヨードアレーンを合成できる点もメリットです。また、ヨードアレーンから調製したGrinard試薬と反応物を加熱して、両者の間でハロゲン-ヨウ素交換をさせる方法もあります。
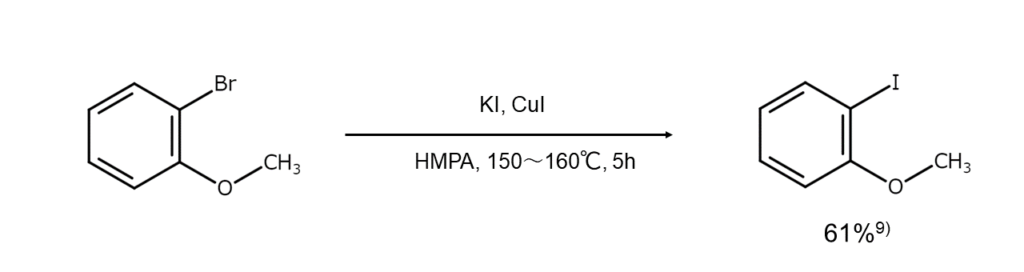
また、反応物がブロモアレーンの場合は、DMFやHMPAのような配位性に優れた極性溶媒中でCuIの存在下にヨウ化アルカリと加熱する方法(以下の反応式を参照)や、ニッケル(II)塩の存在下でヨウ化アルカリと反応させる方法が便利です。ただし、これらの反応はクロロアレーンにはうまく適用できません。
医薬品の製造に貢献するヨードアレーン
ハロゲン交換反応を駆使して合成される、ヨードアレーン。実は、ヨードアレーンは医薬品と深い関わりがあることをご存じでしょうか。
ヨードアレーンは、「超原子価ヨウ素化合物(1より大きな原子価のヨウ素原子を含む化合物)」を合成する際の出発物質です10)。超原子価ヨウ素化合物は、安定で揮発しにくい、反応性が高い、毒性をほとんど示さないといった多くのメリットをもつ有用な物質で、医薬品やファインケミカルなどの分野で活躍しています。
例えば、超原子価ヨウ素化合物は医薬品原薬を合成する際の酸化剤として使用されます。従来の重金属系酸化剤とは異なり、毒性が低く環境にやさしい酸化剤なので、原薬などの安全性を重視する化合物の合成に適しているのです。
ヨードアレーンは、超原子価ヨウ素化合物の製造を通して、日々私たちの健康に貢献していると言えるでしょう。
マナックは、最もシンプルな構造の超原子価ヨウ素化合物「DAIB」を販売しています。「製造コストの高さ」や「副生物の生成」といった問題をクリアした独自の製法で、低コストで高品質な製品をご提供します。DAIBの詳細や製法開発ストーリーに関しては、以下の記事をご覧ください。
参考文献
1) 鈴木仁美 監修、マナック(株)研究所 著、「臭素およびヨウ素化合物の有機合成 試薬と合成法」、丸善出版
2) Finkelstein, H. Ber. 1910, 43, 1528.
3) Hoffmann, H. M. R., Haase, K. Synthesis, 1981, 715.
4) Hoffmann, H. M. R., Haase, K. et al. Synthesis, 1982, 237.
5) Hoffmann, H. M. R., Iranshahi, L. J. Org. Chem., 1984, 49, 1174.
6) Bunnett, J. F., Conner, R. M. J. Org. Chem., 1958, 23, 305; Org. Synth. Coll. Vol. V, 478 (1973).
7) Coad, P., Coad, R. A. et al. J. Org. Chem., 1963, 28, 218.
8) Cottet, F., Castagnetti, E. et al. Synthesis, 2005, 798.
9) Suzuki, H., Kondo, A. et al. Chem. Lett., 1985, 411.
10) Watanabe, A., Miyamoto, K. et al. J. Org. Chem., 2018, 83, 14262.