カルボン酸、ニトロ化合物など不活性な芳香族化合物のヨウ素化:芳香族化合物のヨウ素化反応③:臭素化・ヨウ素化反応解説シリーズ 17
マナックが得意とする、臭素化・ヨウ素化反応について解説する本シリーズ。これまで2回にわたって、単体ヨウ素を用いた「芳香族化合物のヨウ素化反応」として、芳香族炭化水素、フェノール、アニリンなどのヨウ素化について解説してきました。前回は電子供与基で強力に活性化された芳香族化合物のヨウ素化について取り上げましたが、今回は逆に、ニトロ基、カルボキシ基などの電子求引基で不活性化された、ニトロ化合物、芳香族カルボン酸などの芳香族化合物のヨウ素化について解説します。
これまでにご紹介したように、単体ヨウ素は、常温で固体であるため、他のハロゲンよりも危険性が低く、取り扱いが簡単であるといった利点があります。
ただ、そんな便利な単体ヨウ素でも、不活性な芳香族化合物をヨウ素化できるの?といった疑問をお持ちの方もいるかもしれません。確かに、通常のヨウ素化剤では、不活性な芳香族化合物をヨウ素化することは困難です。ところが、触媒、助剤、酸化剤などを利用すれば、不活性化な芳香族化合物をヨウ素化できるようになるのです。そのような不活性化な芳香族化合物をヨウ素化の反応例を詳しく解説しますので、ぜひ実験の参考にしてください。
■ この記事でわかること ✔ 通常のヨウ素化剤では反応しない化合物をヨウ素化するために、無機塩、発煙硫酸、酸化剤、フッ素などを使用する特殊な方法が必要 ✔ 選択的ヨウ素化技術は、高収率で目的化合物を得ることができ、産業分野や医療分野で広く利用される ✔ 体内では甲状腺ホルモン合成時にチロシンがヨウ素化されるなど、化学反応と似た仕組みで生命維持に重要な役割を果たしている ■ おすすめ記事 ・ アルカンのヨウ素化:脂肪族化合物のヨウ素化反応①:臭素化・ヨウ素化反応解説シリーズ 18 ・ フェノールとフェノールエーテルのヨウ素化、アニリンと関連化合物のヨウ素化:芳香族化合物のヨウ素化反応②:臭素化・ヨウ素化反応解説シリーズ 16 ・ 炭化水素のヨウ素化:芳香族化合物のヨウ素化の概要と反応:芳香族化合物のヨウ素化①:臭素化・ヨウ素化反応解説シリーズ 15
contents
単体ヨウ素による芳香族化合物のヨウ素化反応:カルボン酸、ニトロ化合物など不活性な芳香族化合物のヨウ素化
先にも触れましたが、芳香族のニトロ化合物、カルボン酸、ニトリル、ポリハロゲン誘導体、キノンなどは反応性が低いため、通常のヨウ素化剤でヨウ素化することは困難です。そこで、これを解決するために以下のような方法が利用されます。
1)無機塩を用いて次亜ヨウ素酸やヨードカチオン種を発生させる方法
2)発煙硫酸を用いてヨウ素カチオン種を発生させる方法
3)強力な酸化剤を用いる方法
4)フッ素を用いる方法
以下に、これらの方法の反応例を紹介します。
1)無機塩を用いて次亜ヨウ素酸やヨードカチオン種を発生させる方法
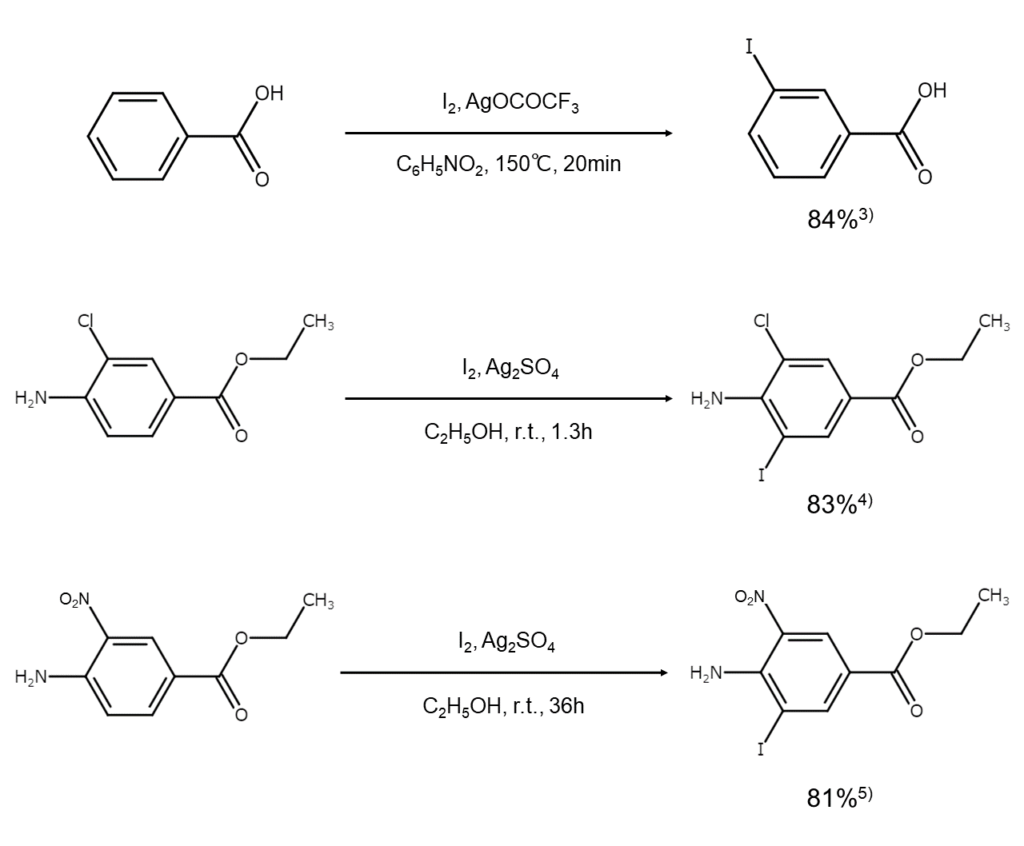
1つ目の方法は、無機塩を用いる方法です。銀、水銀、銅などの無機塩を用いて、以下のように、単体ヨウ素からより強いヨウ素化能力を持つ次亜ヨウ素酸やヨードカチオン種を発生させます。
Ag2SO4 + 2I2 → 2I+ + SO42- + 2AgI
発生したヨードカチオンが芳香環を攻撃し、芳香環の水素と置き換わるかたちで芳香環に結合します。
また、銀塩を用いたWatersらのヨウ素化反応は古くから有名で、実験室の小規模な合成にしばしば利用されています2)。
ヨウ素と銀塩を用いた不活性な芳香族化合物のヨウ素化反応例を、以下に示します。
2)発煙硫酸を用いてヨウ素カチオン種を発生させる方法
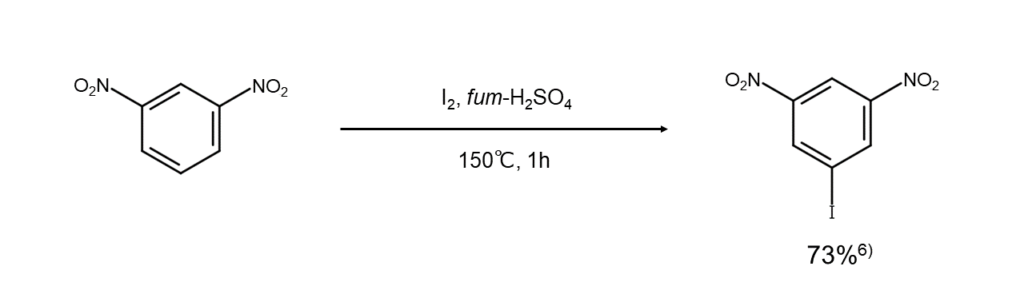
次にご紹介するのは、発煙硫酸を用いる方法です。ヨウ素は通常の硫酸にはほとんど溶けませんが、発煙硫酸には溶けて、溶液中で高次ヨードカチオン種(I3+、I5+、I7+)となります。この溶液中に不活性な芳香族化合物を入れて加熱すると、芳香環のポリヨード化が起こります。この方法を用いると、通常の方法では行うことができない、ベンゼンのヘキサヨード化さえも可能です。
3)強力な酸化剤を用いる方法
上記のような発煙硫酸を用いた芳香環のポリヨード化の他に、酸化剤としてペルオキソ二硫酸カリウム:K2S2O8を用いてヨードカチオンを発生させ、不活性な芳香族化合物をポリヨード化する方法もあります。
4)フッ素を用いる方法
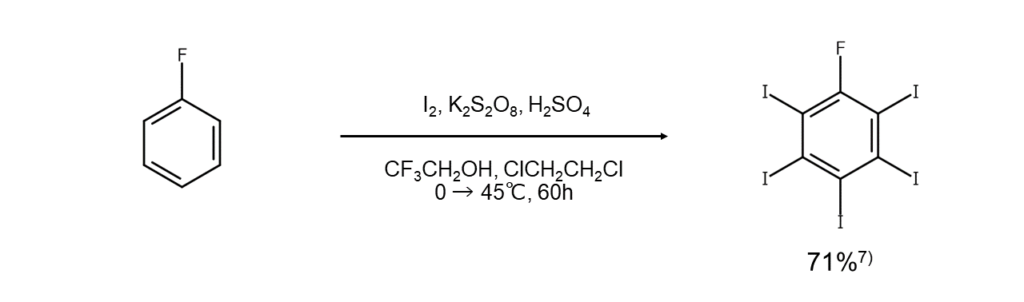
最後にご紹介するのは、フッ素を助剤として用いる方法です。実は、この方法は単体ヨウ素を用いて不活性な芳香族化合物をヨウ素化するのに最も強力な方法です。
まず、導入したいヨウ素の個数に合わせて基質とヨウ素のモル比を選びます。例えば、2個のヨウ素を導入したい場合は基質:ヨウ素= 1:2.2のモル比、3個のヨウ素を導入したい場合は1:3.2のモル比を選択します。これらを98%硫酸とフレオン-113(CCl2FCCl2F)の混合液に分散させ、室温でかきまぜながら、窒素で5~10%に希釈したフッ素ガスを吹き込みます。この後、ヨウ素化は速やかに完了するので、反応混合物を氷水へ注いで生成物をジクロロメタンで抽出します。溶媒を取り除き、残分を蒸留または再結晶によって精製すると、ポリヨード化合物を得ることができます。
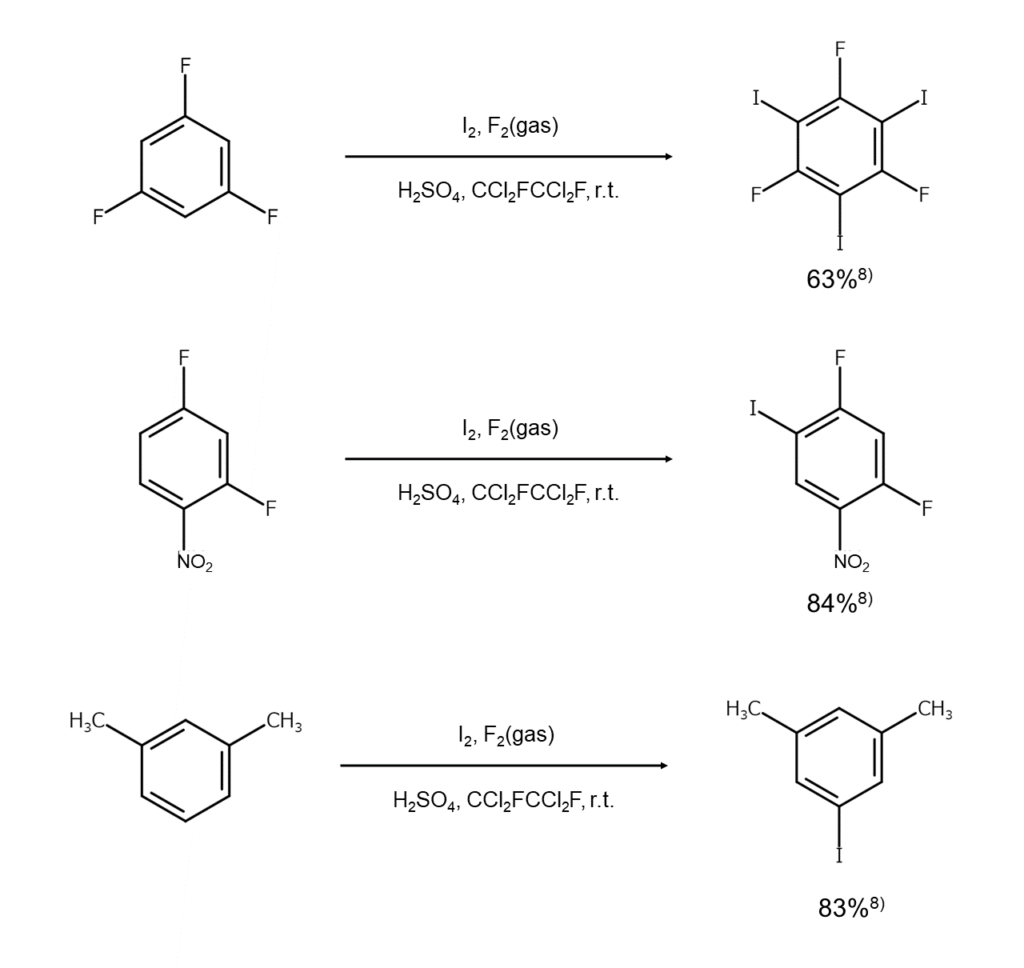
基質とヨウ素のモル比を調整することで目的のポリヨード化合物が選択的に得られる点や、そのような目的の化合物が高収率でただちに得られるといった点は、この方法の大きなメリットです。
このように、一見難しいように思われる不活性な芳香族化合物のヨウ素化も、上記のような方法を用いてヨウ素化することが可能です。「この化合物を作りたいけれど可能なのか?」といった疑問も、マナックの「ヨウ素化技術」「ヨウ素取り扱い技術」によって解決できるかもしれません。ぜひマナックにご相談ください。
【一息コラム】
実は、芳香族化合物のヨウ素化は生体内でも行われている!
これまで3回にわたって、単体ヨウ素による芳香族化合物のヨウ素化について解説してきました。単体ヨウ素と芳香族化合物をそのまま混合するだけでは反応が進まないため、基質である芳香族化合物の種類に合わせて助剤や触媒の力を借りることが、単体ヨウ素による芳香族化合物のヨウ素化の特徴でした。
そのような単体ヨウ素による芳香族化合物のヨウ素化は、実は、実験室の場だけではなく、わたしたちの体内でも行われています。それは、甲状腺ホルモンであるトリヨードチロニンと、チロキシンを分泌する過程で起こります。
甲状腺ホルモンは、身体の発育や新陳代謝に関わるホルモンです。そんな甲状腺ホルモンの合成で特に重要なのが、ヨウ素とチロシン(芳香族α-アミノ酸の一種)という2つの原材料。甲状腺ホルモンが分泌される過程で、芳香族化合物であるチロシンがヨウ素化され、ヨウ素が3つ付いたトリヨードチロニン(T3)と、4つ付いたチロキシン(T4)が生成されます。この反応は、どのようなメカニズムで起こっているのでしょうか?その秘密を探ってみましょう。
脳の下垂体からの命令を受けて甲状腺が刺激されると、甲状腺内部の甲状腺濾胞上皮細胞内で甲状腺ホルモンの合成が開始されます。甲状腺の中には、コロイド状の甲状腺濾胞が無数にあります。この甲状腺濾胞の表面内側には濾胞腔上皮細胞が並んでいます。そのさらに内側の濾胞腔が、甲状腺ホルモンの合成の場です。
甲状腺ホルモンの合成の過程は、大きく以下の3つに分けられます。
甲状腺ホルモン合成の過程
1) ヨウ素の取り込み
2) チロシンのヨウ素化
3) カップリングによるトリヨードチロニンとチロキシンの生成
ヨウ素の取り込み
食物中に含まれているヨウ素は、食べて吸収されると、血液中に取り込まれます。甲状腺が脳から命令を受けて刺激されると、甲状腺濾胞上皮細胞が血管からヨウ素を取り込みます。取り込まれたヨウ素は、濾胞上皮細胞を通って濾胞腔へと放出されます。
チロシンのヨウ素化
濾胞上皮細胞内で、基質であるサイログロブリンとペルオキシターゼという酸化酵素が合成され、濾胞腔へと放出されます。サイログロブリンには、多数のチロシン(芳香族α-アミノ酸)が含まれています。そして、同じく濾胞上皮細胞によって合成されたペルオキシダーゼによってヨウ素が酸化されてヨードカチオンに変化します。このヨードカチオンがサイログロブリンに含まれている芳香族のチロシンに作用し、チロシンがヨウ素化され、モノヨードチロシンやジヨードチロシンに変換されます。
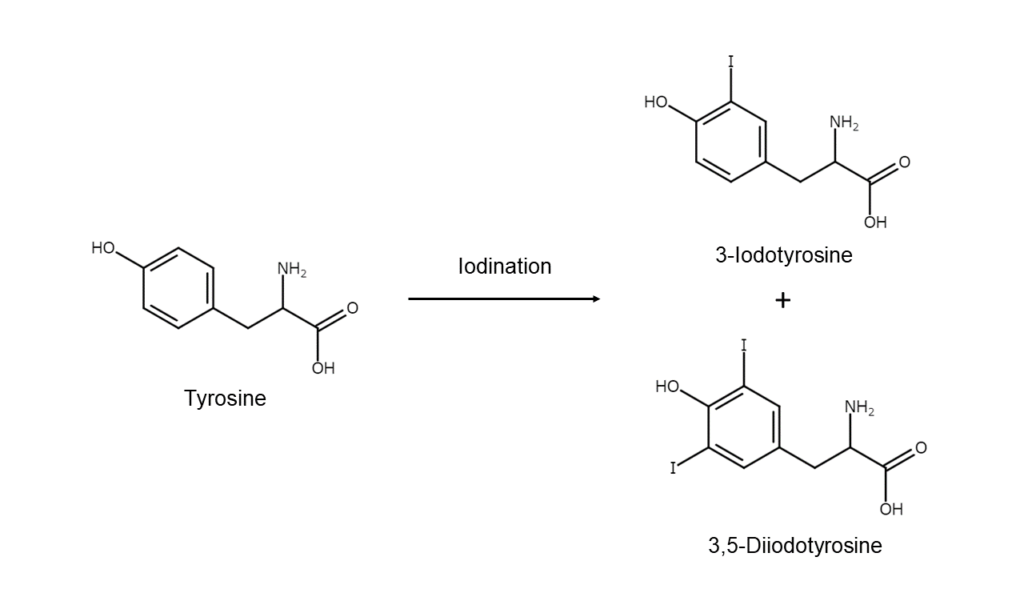
ヨウ素のカチオン化や芳香族のヨウ素化といった、これまでご紹介してきた芳香族化合物のヨウ素化が、生体内でも類似したメカニズムで起こるのです。体内での酸化酵素の役目を、実験の場では、今回ご紹介したような無機塩や発煙硫酸などが担っているのです。
カップリングによるトリヨードチロニンとチロキシンの生成
チロシンのヨウ素化により生成されたモノヨードチロシンやジヨードチロシンは、その後、ペルオキシターゼと過酸化水素によって酸化カップリングされます。このカップリングにより、トリヨードチロニン(T3)と、チロキシン(T4)が生成します。
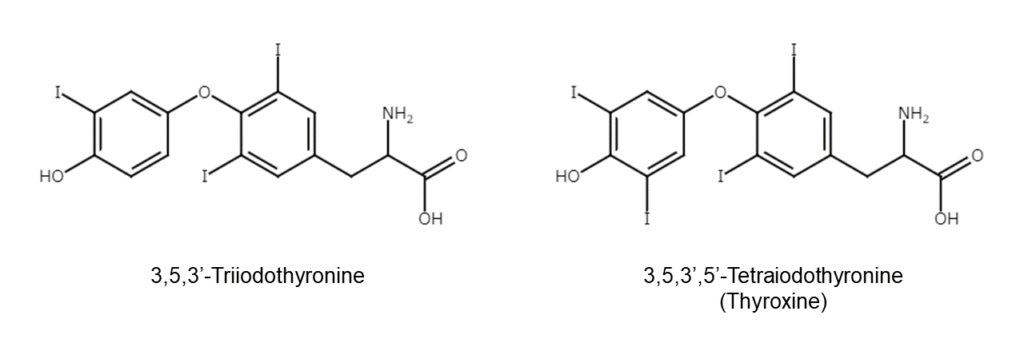
こうしてできたトリヨードチロニン(T3)とチロキシン(T4)は一時的に濾胞腔内に貯蔵された後に、再び濾胞上皮細胞に取り込まれて血管中に分泌されます。通常、甲状腺では主にT4が作られます。T3も甲状腺で作られますが、その量はT4の10分の1程度で、残りは肝臓などの臓器で作られます。臓器中で作られるT3は、一から新たに作られるわけではありません。臓器に運ばれたT4から脱ヨウ素酵素の働きでヨウ素が1つ外れることで、作られるのです。外れたヨウ素の一部は再利用され、残りは排泄されます。工業的に見ても高価で回収して再利用されることが望ましいヨウ素ですが、体内でもその一部が再利用されているのです。
このように、体内における物質の合成メカニズムには、化学合成で行われているメカニズムと共通するところがあります。ヨウ素は、扱い易さといった利点のためにハロゲン化物を作るのに有用なだけではなく、体内でもわたしたちの身体の機能を維持するために重要な役割を果たしています。
単体ヨウ素による芳香族化合物のヨウ素化については、今回が最後です。
次回からは、単体ヨウ素による脂肪族化合物のヨウ素化を解説していきます。
参考文献
1) 鈴木仁美 監修、マナック(株)研究所 著、「臭素およびヨウ素化合物の有機合成 試薬と合成法」、丸善出版
2) Barker, I. R. L., Waters, W. A. J. Chem. Soc., 1952, 150.
3) Haszeldine, R, N., Sharpe, A. G. J. Chem. Soc., 1952, 993.
4) Stoll, A., H., Knochel, P. Org. Lett., 2008, 10, 113.
5) Koradin, C., Dohle, W. et al. Tetrahedron, 2003, 59,1571.
6) Fletcher, T. L., Namkung, M. J. et al. J. Org. Chem., 1960, 25, 1342.
7) Rahman, Md. A. Shito, F. et al. Synthesis, 2010,27.
8) Rozen, S., Zamir, D. J. Org. Chem., 1990, 55, 3552.