臭化水素を用いた臭素化反応とは:臭化水素①:臭素化・ヨウ素化反応解説シリーズ 34
マナックが得意とする臭素化・ヨウ素化反応について解説する本シリーズは、今回から「臭化水素を用いた臭素化反応」に入ります。
臭化水素やその水溶液である臭化水素酸は、臭素化反応の代表的な試薬です。これらの試薬には、「反応条件次第で同じ基質から異なる生成物を合成できる」という便利な特徴があります。臭素化反応を学ぶ上で、ぜひとも押さえておきたい試薬なのです。
この記事では、臭化水素を用いた臭素化反応の概要を説明した後、臭化水素および臭化水素酸の性質や注意点をくわしく解説します。ぜひ、実験の参考にしてください。
contents
臭化水素を用いた臭素化反応とは
酸性条件下での代表的な臭素化反応
臭化水素HBrは無色の刺激性気体で、酸性条件下で臭素化を行う際の代表的な試薬です。
▽アルケン、アルキン、アルコールなどのブロモアルカンやブロモアルケンへの変換
▽エーテルやラクトンの臭素化開裂
▽芳香環のブロモメチル化
▽ニトリルのブロモイミンへの変換
などに利用されます。
臭化水素と酸化剤を併用し、発生した臭素をin situで臭素化剤として使用する場合もあります。
臭化水素の水溶液は、臭化水素酸と呼ばれます。臭化水素はさまざまな極性・無極性溶媒によく溶解しますが、実験室では臭化水素酸の状態で使用されるのが一般的です。
臭化水素が臭素化に関与するメカニズムはさまざまです。
例えば、極性溶媒中では臭素イオンBr–として、非極性溶媒中では(光やラジカル反応開始剤が存在すると)臭素原子Br・として反応に関与します。反応条件を変更することで同じ基質・試薬から異なる生成物を得られる点は、大きなメリットと言えるでしょう。
臭化水素を用いた臭素化反応一覧
本シリーズでは今後、以下の臭素化反応を順に解説していきます。
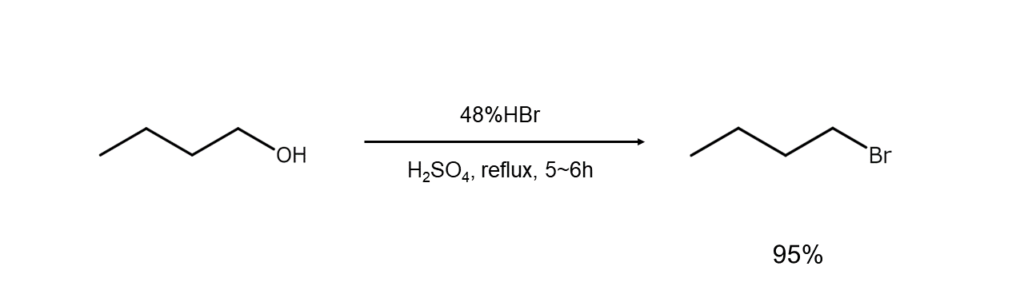
① アルコールからブロモアルカンの合成
ブロモアルカンの代表的な合成法です。第一級および第二級アルコールの場合は臭化水素酸と穏やかに加熱する必要がありますが、第三級アルコールの場合は試薬と混合後に室温で撹拌するだけで反応が進行します。
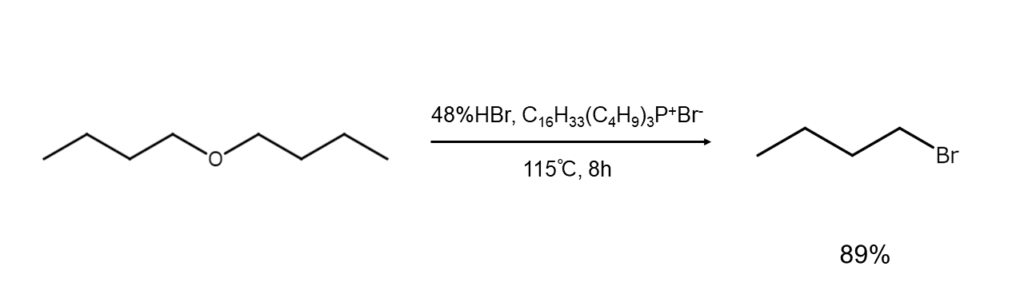
② エーテルやラクトンの開裂によるブロモアルカンの合成
エーテルは臭化水素や臭化水素酸の作用で開裂して、ブロモアルカンとアルコールを与えます。反応機構は基質に応じて異なります。
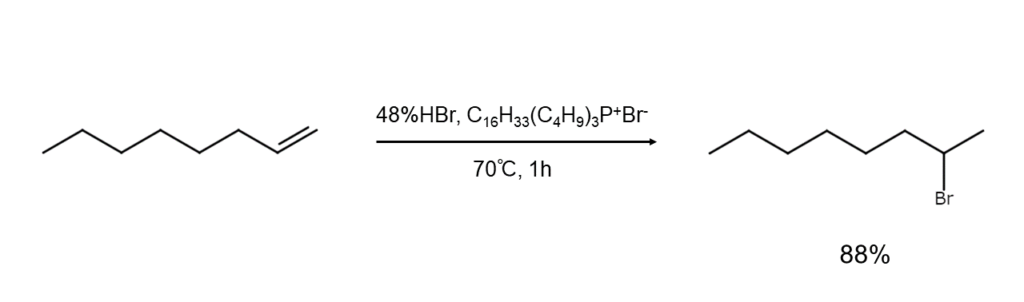
③ アルケンへの付加
臭化水素は室温でアルケンに容易に付加してブロモアルカンを生成します。極性溶媒中ではMarkovnikov付加、無極性溶媒中では逆Markovnikov付加が起こります。
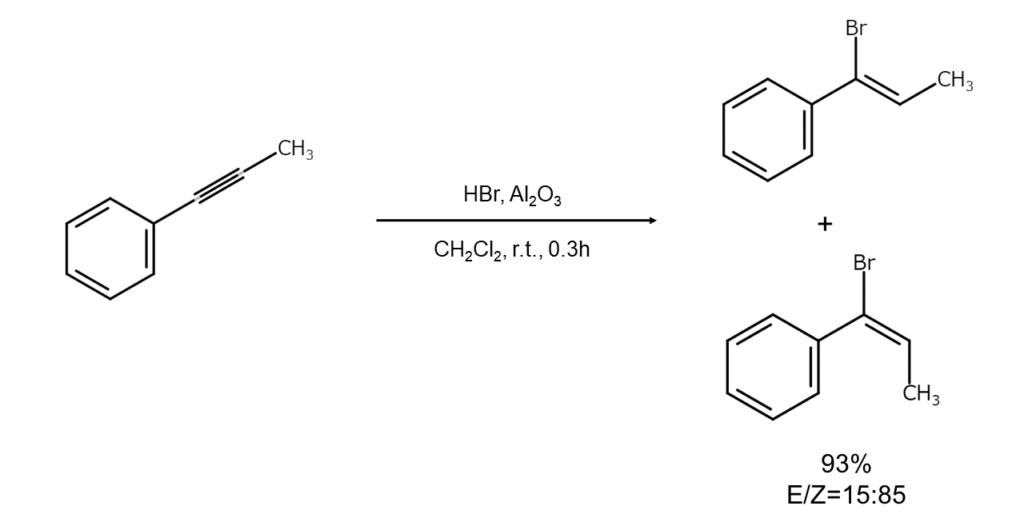
④ アルキンへの付加
アルキンに対する臭化水素の付加反応は一般に遅いため、通常はCuBrなどの触媒を利用します。極性溶媒中と非極性溶媒中における付加方向の違いは、アルケンの場合ほど明確ではありません。
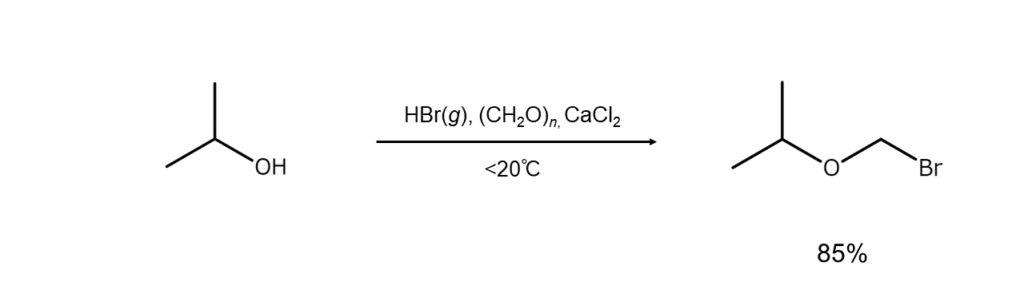
⑤ ブロモメチル化
臭化水素とパラホルムアルデヒドを使えば、アルコールのO-ブロモメチル化によりブロモメチルエーテルが高収率で得られます。また、芳香族炭化水素に臭化水素とホルムアルデヒドを作用させると対応する臭化ベンジルが得られます。
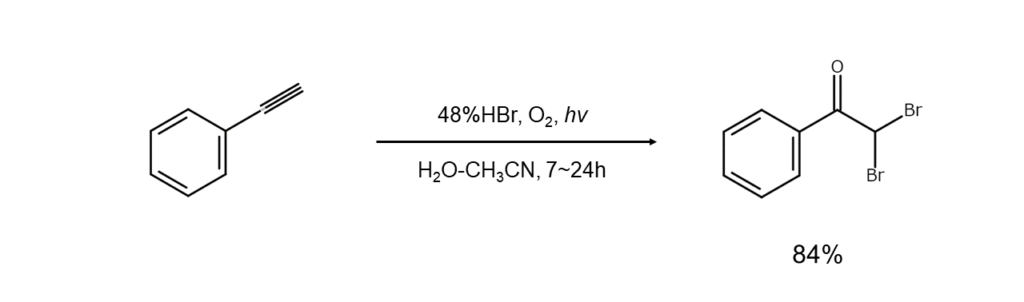
⑥ 臭化水素と酸化剤を組み合わせた臭素化
臭化水素と酸化剤を組み合わせて臭素を発生させ、この臭素をin situに臭素化剤として使用する方法です。臭素をごく低濃度に抑えた状態で反応を実施できます。
⑦ 臭化水素を用いたその他の合成
活性化された芳香族臭素化合物を題材に、臭素原子の転移反応などを解説します。
臭化水素および臭化水素酸の特徴や注意点
最後に、臭化水素および臭化水素酸の化合物としての特徴や注意点を説明します。実験の前に必ず確認しておいてください。
臭化水素
臭化水素(分子量:80.912)は、無色の刺激性気体で燃えにくく、湿った空気に触れると白煙を発生します。きわめて安定ですが、高温ではわずかに臭素と水素へ解離します(329℃で0.0035%、1222℃で1.08%)。また、水や酢酸、アルコール、エーテル、液体SO2などの含酸素溶媒によく溶けます。
臭化水素は希薄状態でも上部気道や粘膜を強く刺激するため、暴露は避けなければいけません。万が一吸い込むと、激しい咳や喉の灼熱感、胸の痛みなどが起こり、粘膜下壊死をともなって炎症が発生します。許容濃度は米国で3ppm(9.9 mg/m3以下)、ドイツで2ppm(6.7 mg/m3)以下とされています。
臭化水素酸
臭化水素酸は臭化水素の水溶液で、pKa < -7の強酸です。濃度47.63%で共沸混合物(沸点:124.3℃)を形成するので、通常はこの濃度の水溶液が市販されています。
純粋な臭化水素酸は無色の発煙性液体ですが、保存中に徐々に酸化されて臭素が遊離するため、次第に黄色を帯びてきます。この着色は光で促進されるため、保存には暗色のガラス瓶を用いる必要があります。
【コラム】水素の製造過程でも登場する臭化水素
「2050年までにカーボンニュートラルを実現する」という世界的な動き2)の中、化石燃料に変わる新たな燃料として「水素」に注目が集まっています。水素は多様な資源から製造でき、使用時(燃焼時や燃料電池での発電時)に二酸化炭素を排出しないことから、カーボンニュートラルの実現に大きく貢献できるのではと考えられているのです3)4)。
水素の製造技術のひとつとして知られるのが、「水の熱化学分解」です。実はここに、この記事の主役である「臭化水素」が登場します。
水の熱化学分解とは、水の分解反応(H2O→H2 + 1/2O2)を複数の化学反応に分割することで、比較的低温で反応を進行させる方法です。水を熱エネルギーだけで直接分解しようとすると4000℃程度の高温が必要ですが、熱化学分解を用いると400℃~1500℃程度で済みます5)~7)。
水の熱化学分解にはさまざまな方法があります。中でも、臭化水素が登場するのは「Sulfur-Bromineプロセス」「Ispra Mark13プロセス」などと呼ばれる方法です5)6)。この方法では、以下のように水に臭素と酸化硫黄を反応させて臭化水素と硫酸を合成し、臭化水素の熱分解で水素を、硫酸の熱分解で酸素を製造します。
Br2 + SO2 + 2H2O → 2HBr + H2SO4
2HBr → H2 + Br2
H2SO4 → H2O + SO2 + 1/2O2
水の熱化学分解は太陽光を熱源として使用できることから、二酸化炭素を使用しない水素製造法として多方面から期待されています8)。水素社会の実現に向けて、今後も研究開発が進められることでしょう。
マナックは、臭素化・ヨウ素化反応における世界的なリーディングカンパニーです。臭素化・ヨウ素化反応にお困りの方は、お気軽にお問い合わせください。
参考文献
1) 鈴木仁美 監修、マナック(株)研究所 著、「臭素およびヨウ素化合物の有機合成 試薬と合成法」、丸善出版
2) 経済産業省資源エネルギー庁、「令和2年度エネルギーに関する年次報告 第1部 エネルギーをめぐる状況と主な対策 第2章 2050年カーボンニュートラル実現に向けた課題と取組 第2節 諸外国における脱炭素化の動向」、
https://www.enecho.meti.go.jp/about/whitepaper/2021/html/1-2-2.html
3) 経済産業省資源エネルギー庁、「カーボンニュートラル実現に向けた鍵となる『水素』」、
https://www.enecho.meti.go.jp/category/saving_and_new/advanced_systems/hydrogen_society/
4) 特許庁、「令和4年度特許出願技術動向調査報告書 カーボンニュートラルに向けた水素・アンモニア技術」、
https://www.jpo.go.jp/resources/report/gidou-houkoku/tokkyo/document/index/2022_05.pdf
5) 表面科学 Vol. 36, No. 2, pp. 80-85, 2015 特集「水素の作り方」、
https://www.jstage.jst.go.jp/article/jsssj/36/2/36_80/_pdf/-char/ja
6) 松本広重(九州大学)、「水素製造システム(第7回)熱化学水素製造」、
https://i2cner.kyushu-u.ac.jp/~matsumoto/wp01/wp-content/uploads/2018/12/IM820_HydrogenProductionSystem_7_2018.pdf
7) 宮岡裕樹、小島由継、市川貴之(広島大学)、「低温熱化学水分解による水素精製技術」、
https://www.hiroshima-u.ac.jp/system/files/42424/kaiken-siryou2.pdf
8) 国立研究開発法人日本原子力研究開発機構 高温ガス炉と水素・熱利用研究、「熱化学法ISプロセスとは」、
https://www.jaea.go.jp/04/o-arai/nhc/jp/faq/is_process.html