臭化リンを用いた臭素化反応の概要、臭化リンを用いた臭素化反応(臭化リン(III)):臭化リン①:臭素化・ヨウ素化反応解説シリーズ 39
マナックが得意とする臭素化・ヨウ素化反応について解説する本シリーズは、今回から「臭化リンを用いた臭素化反応」に入ります。
臭化リンと一言で言っても、臭化リン(III)や臭化リン(V)、臭化ホスホリルなど、その種類はさまざま。各試薬を用いた一連の臭素化反応を体系的にマスターできれば、実験や研究を進める上で大いに役立つことでしょう。
この記事では、最初に各臭化リンによる臭素化反応をダイジェストで紹介した後、「臭化リン(III)」を試薬とする反応をくわしく解説します。
contents
臭化リンを用いた臭素化反応の概要
本シリーズでは今後、以下の試薬を用いた臭素化反応を順に解説していきます。
臭化リン(III)(PBr3)
アルコールからブロモアルカンを合成する反応によく使用されます。臭化水素酸を使用する場合に比べて、異性化や脱離反応が起こりにくい点がメリットです。
臭素とリン
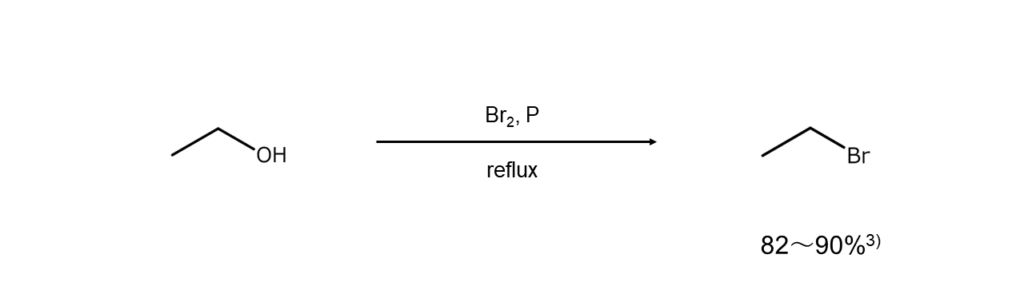
アルコール中でリンに臭素を作用させて、発生したPBr3をin situに利用する方法です。市販のPBr3を使用するよりも安価に済ませることができます。
臭化リン(V)(PBr5)
芳香環やヘテロ芳香環のヒドロキシ基を臭素原子で置換する反応や、アルデヒドを1,1-ジブロモアルカンに変換する反応によく利用されます。PBr3とうまく反応しないアルコールを臭化物に変換する際にも有用です。
臭化ホスホリル(POBr3)
芳香環やヘテロ環のヒドロキシ基を臭素原子で置換する際に利用されます。臭素化能力はPBr5ほど高くないので、無難な試薬と言えます。
ブロモホスホラン
ジブロモトリフェニルホスホランや1,2-ビス(ジブロモジフェニルホスホラニル)エタンは、臭素化試薬として使用されます。アルコールからブロモアルカンを合成する反応や、フェノールからブロモアレーンを合成する反応などに有用です。
臭化リンを用いた臭素化反応:臭化リン(III)を試薬とする反応
臭化リン(III)とは
臭化リン(III)(PBr3)は刺激臭を持つ無色の液体です。腐食性が強く、水分の存在下で多くの金属製品を侵します。蒸気は重く有毒で、皮膚や粘膜を激しく侵すため、取り扱いには注意が必要です。
エーテル、アセトン、ジクロロメタン、トリクロロメタン、二硫化炭素、ベンゼンなどにはよく溶けますが、アルコールとは激しく反応してHBrを発生します。また、乾燥状態では安定に保存できますが、湿気に曝されるとHBrを発生して臭化ホスホリル(POBr3)に変化します。水中では速やかに加水分解され、亜リン酸と臭化水素酸となります。
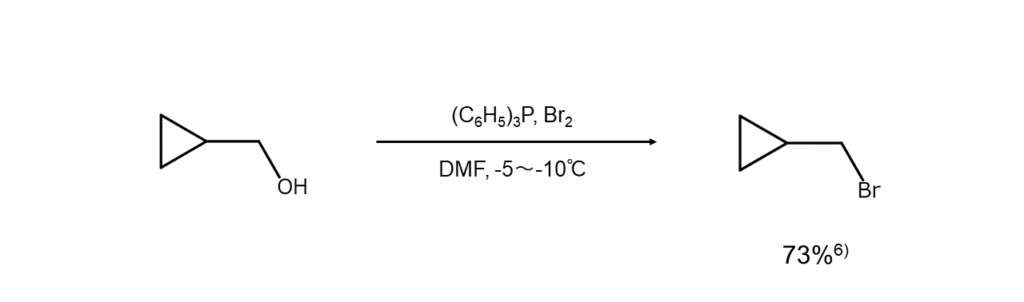
反応①:アルコールからブロモアルカンの合成
反応機構
アルコールからブロモアルカンを合成する試薬としては臭化水素酸も有名ですが、PBr3を使えば異性化や脱離反応の頻度をより減らすことができます。そのため、第二級および第三級アルコールをブロモアルカンに変える際にはPBr3を用いるのが有効です。この際、光学活性なアルコールからは、立体配置が反転した光学活性なブロモアルカンが得られます。
PBr3による臭素化反応は以下のように、「加アルコール分解による亜リン酸エステルおよびその前駆体の生成(以下の式(1))」と、「同時発生するHBrによるこれらの臭素化分解(以下の式(2))」という2段階で進行します。
ROH + PBr3 → Br2POR, BrP(OR)2, P(OR)3 + HBr 式(1)
Br2POR, BrP(OR)2, P(OR)3 + HBr → RBr + H3PO3 式(2)
上記の反応では、1個のヒドロキシ基に対して0.33~0.40当量のPBr3が必要です。PBr3の量比が少ないと有機リン化合物(Br2POR, BrP(OR)2, P(OR)3)の副生が多くなりますが、これらの粗生成物を改めて濃い臭化水素酸で処理すれば収率を向上させることも可能です。
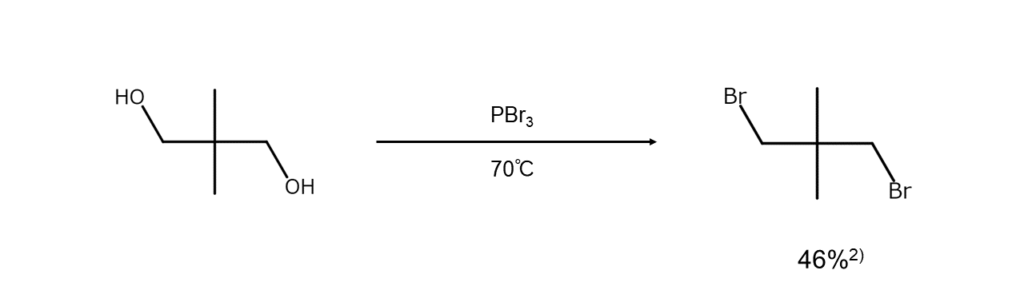
以下に、PBr3を用いたアルコールからブロモアルカンの合成例を示します。
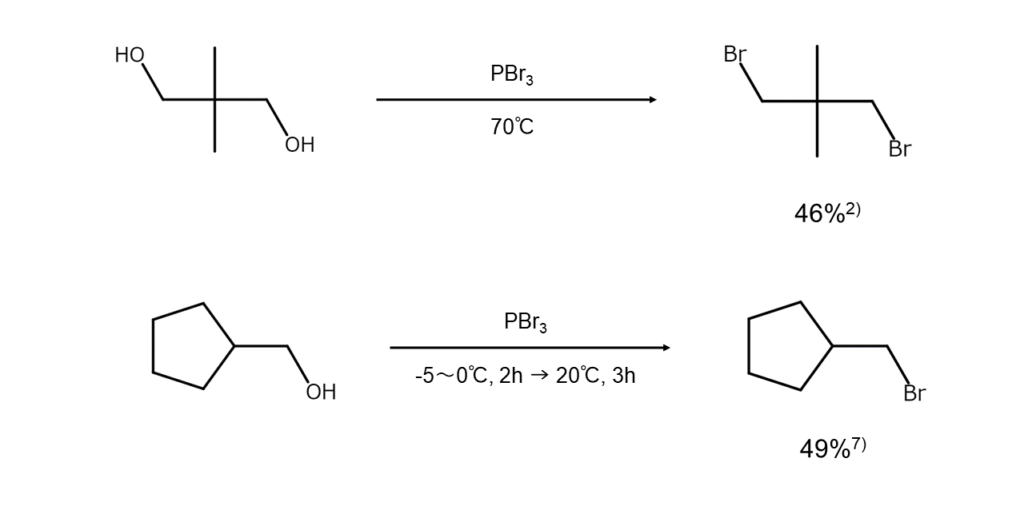
さまざまな構造のアルコールに適用できる
分子内に二重結合や三重結合を持つアルコールも、PBr3を用いると以下のように臭化物へ変換できます。ただし、臭化水素の付加や亜リン酸エステルの生成が避けられない場合には、アルコールをいったんトシレート(p-トルエンスルホン酸のエステル)に変えて、これを臭化アルカリで処理する手もあります。
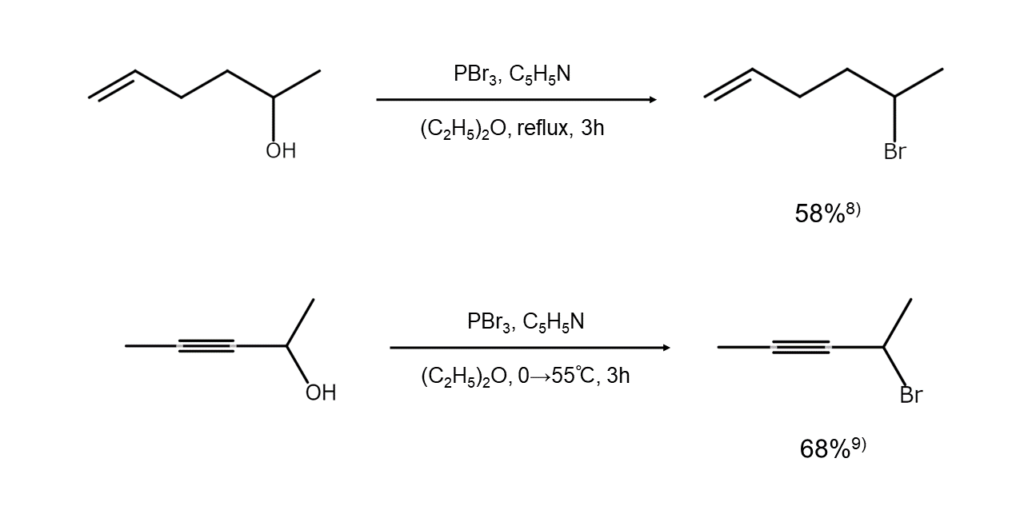
分子内にポリエン構造やエーテル結合が存在していても、これらを残したままヒドロキシ基を臭素原子で置換することが可能です。
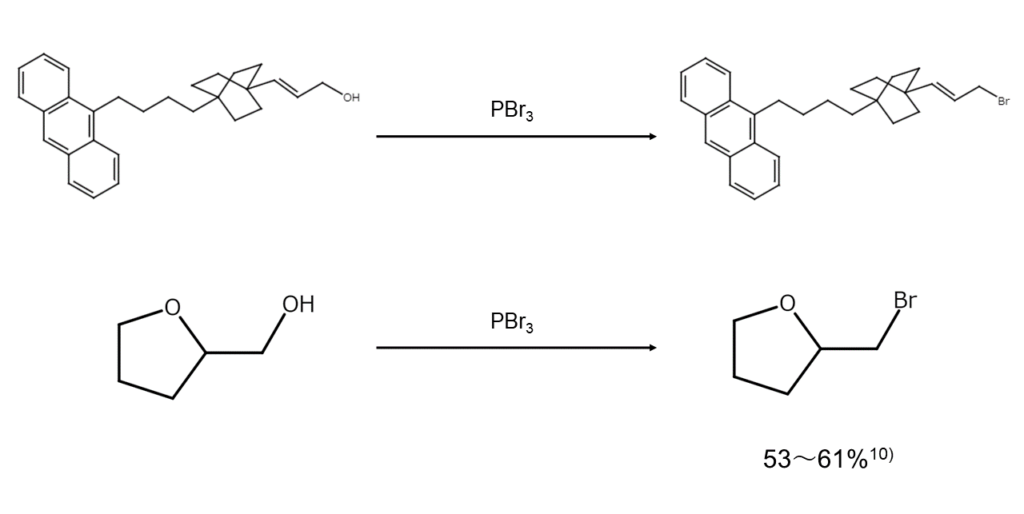
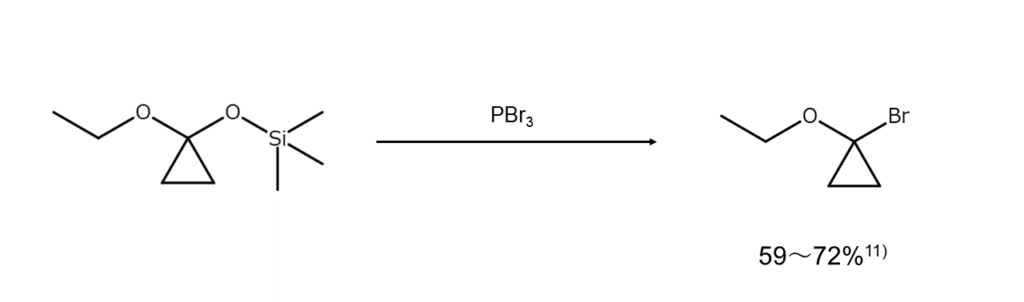
また、アルコールではありませんが、O-シリルシクロプロパノンアセタールをα-ブロモエーテルへ変換する興味深い反応も報告されています。
PBr3の加え方や反応温度には注意が必要
PBr3を用いたアルコールからブロモアルカンの合成反応は、アルコール中にPBr3を滴下する方法で実施するのが普通です。逆の加え方をすると暴走反応の原因になりやすいため、注意してください。また、反応中に急速に>100℃に加熱すると猛毒のホスフィンが発生する可能性があるため、温度管理にも気を配りましょう。
反応後の混合物から目的物を得るためのコツ
反応後の混合物は、多量の水で処理するのが一般的です。ただし、酸に敏感な化合物の場合はメタノールで処理すると好結果が得られます。亜リン酸エステルが多量に副生する場合は、抽出溶媒に石油エーテルを用いるか、目的物が低沸点ならば水蒸気蒸留を行うと、その混入を防ぐことができます。
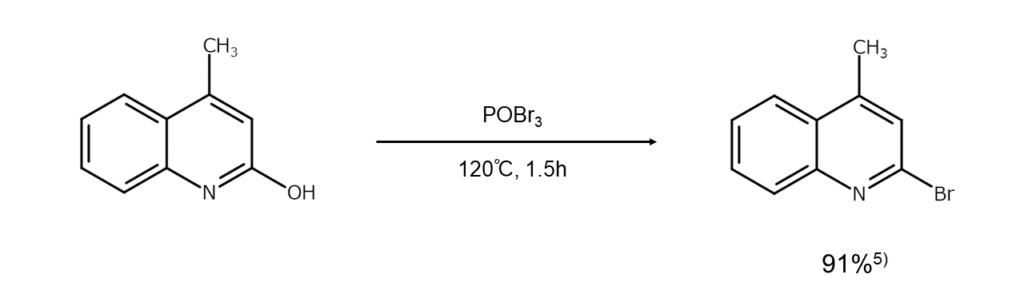
反応②:フェノールからブロモアレーンの合成
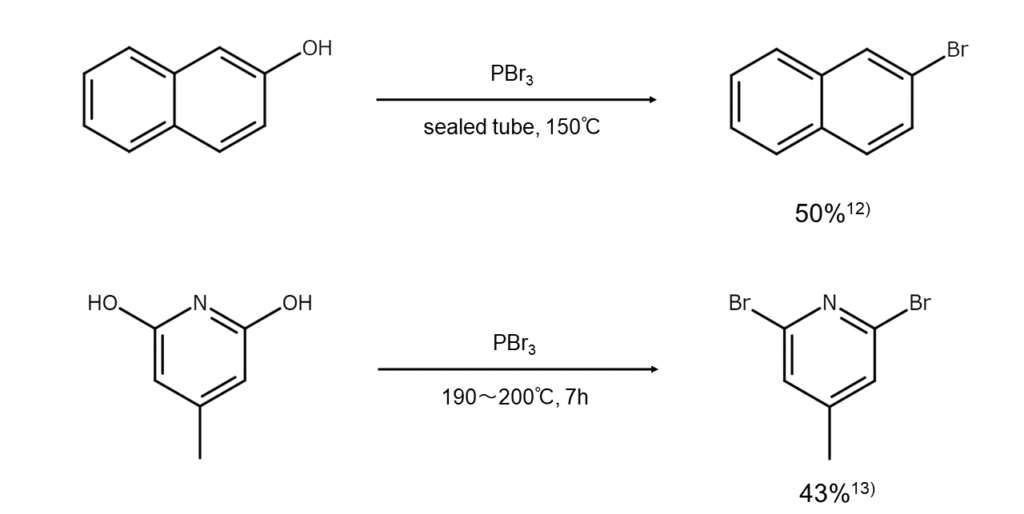
一般性には欠けますが、2-ナフトール、2-または4-ピリジノール、2-または4-キノリノールなどは、PBr3とともに高温で長時間加熱するとヒドロキシ基が臭素原子で置換され、対応するブロモアレーンやブロモへテロアレーンに変化します。樹脂化をともないやすいため、収率はあまりよくありません。
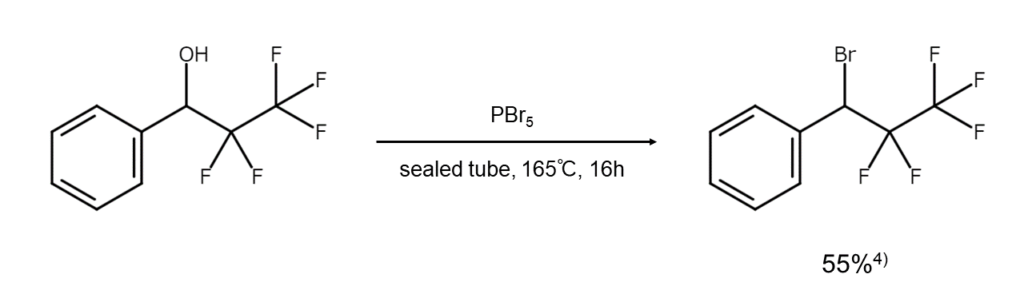
代表的な反応例を以下に示します。
【コラム】ポリマーの劣化を防ぐ! 亜リン酸エステルの効果とは
今回の記事では、アルコールからブロモアルカンを合成する際に副生する「邪魔者」として登場した「亜リン酸エステル」。実は、巷ではプラスチックの劣化を防ぐ「酸化防止剤」として活躍していることをご存じでしょうか?
ポリエチレンやポリプロピレンなどのプラスチックは、安い、軽い、成型しやすい、錆びないといった優れた特徴を持つことから、現代社会で幅広く活用されています。ただし、加工中・製品化後に光や熱に曝され続けるとラジカル反応によって劣化が進行するため、各種の安定剤を添加して劣化を防ぐのが一般的です。この安定剤の一種である「酸化防止剤」として、亜リン酸エステルが使用されているのです。
亜リン酸エステルは、プラスチック(RH)の劣化過程で発生するハイドロパーオキサイド(ROOH)をROHに還元する作用を持ちます。これにより、ROOHの分解によるラジカルの発生を抑制して、プラスチックの劣化要因を減らすことができるのです14)。
ある場面では「副生物」として邪魔者扱いされる化合物も、別の場面では私たちの生活を支える「酸化防止剤」として働く。化合物には、さまざまな「顔」があるのですね。
参考文献
1) 鈴木仁美 監修、マナック(株)研究所 著、「臭素およびヨウ素化合物の有機合成 試薬と合成法」、丸善出版
2) Shortridge, R. W., Craig, R. A. et al. J. Am. Chem. Soc., 1948, 70, 946.
3) Goshorn, R. H., Boyd. T. Org. Synth. Coll. Vol. I, 36 (1941).
4) Dannley, R. L., Weschler, J. R. et al. J. Am. Chem. Soc., 1955, 77, 3643.
5) Kaslow, C. E., Marsh, M. M. J. Org. Chem., 1947, 12, 456.
6) Hrubiec, R. T., Smith, M. B. J. Org. Chem., 1984, 49, 431.
7) Noller, C. R., Adams, R. J. Am. Chem. Soc., 1926, 48, 1080.
8) Wood, jr. H. B., Horning, E. C. J. Am. Chem. Soc., 1953, 75, 5511.
9) Smith, L. I., Swenson, J. S. J. Am. Chem. Soc., 1957, 79, 2962.
10) Smith, L. H. Org. Synth. Coll. Vol. III, 793 (1955).
11) Miller, S. A., Gadwood, R. C. Org. Synth., 1989, 67, 210: Coll. Vol. VIII, 556 (1993).
12) Sah, P. P. T. Rec. trav. chim. Pays-Bas, 1940, 59, 1021.
13) Ames, D. E., Grey, T. F. J. Chem. Soc., 1955, 631.
14) 住友化学工業(株) 有機合成研究所、「新規高性能加工安定剤の開発 -Sumilizer GP-」、https://www.sumitomo-chem.co.jp/rd/report/files/docs/20020205_22s.pdf